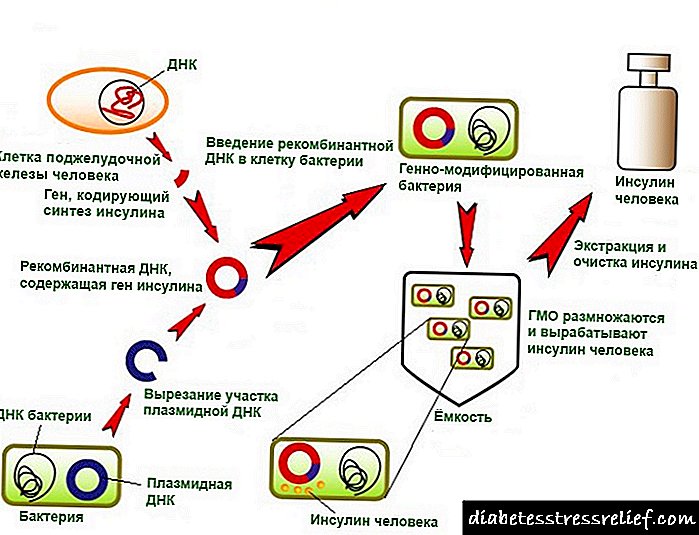
Proizvodnja inzulina genetskog inženjerstva
Inzulin - hormon gušterače koji regulira | metabolizam ugljikohidrata i održavanje normalne razine cazdapau krvi. Manjak ovog hormona u organizmu dovodi.) Do jedne od najozbiljnijih bolesti - dijabetesa koja je kao uzrok smrti na trećem mestu nakon kardiovaskularnih bolesti i raka. Inzulin je mala kugla | protein koji sadrži 51 aminokiselinski ostatak i sastoji se od dva polipeptidna lanca povezana dva disulfidna mosta. Sintetizira se u obliku jednolančanog fetalnog prekursora, preproinsulina, koji sadrži koi peptid sa centralnim signalom (23 aminokiselinska ostatka) i peptid koji povezuje 35 veza (C-peptid). Kada se ukloni signalni peptid, u ćeliji se formira proinsulin iz 86 aminokiselinskih ostataka u kojima su povezani A i B lanci inzulina.C-neitvid, koji im pruža potrebnu orijentaciju u iznosu od 3 USD na disulfidnoj vezi. Nakon proteolitičkog odvajanja C peptida, nastaje inzulin.
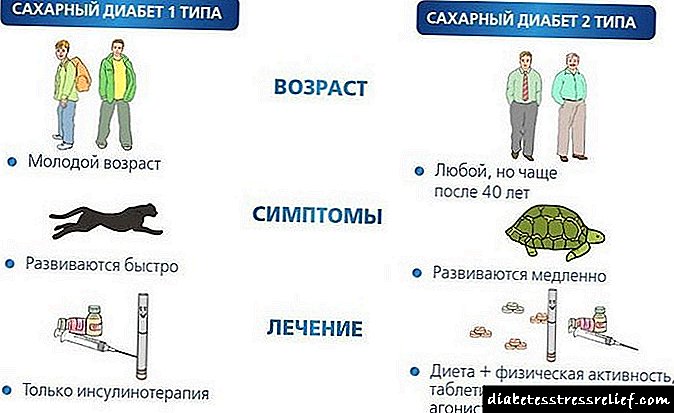
Poznato je nekoliko oblika dijabetesa. Najteži oblik, za liječenje kojeg pacijentu treba inzulin (inzulinski ovisan oblik bolesti), izaziva selektivna smrt ćelija koje sintetišu ovaj hormon (stanice otoka Langerhansa u gušterači). Oblik dijabetes melitusa, za koji nije potrebno liječenje inzulinom, češći je, može se upravljati uz pomoć odgovarajuće prehrane i re:> ma. Obično se gušterača goveda i krava ne koristi u mesnoj i konzervirajućoj industriji i postavlja se u hladnjačarske automobile za farmaceutska preduzeća u kojima se vrši ekstrakcija hormona. Za 100 g cr! Za talski inzulin potrebno je 800-1000 kg sirovina
Sinteza oba lanca i povezivanje njihovih disfidnih veza radi dobijanja inzulina provedeni su u 1963. i 1965. godini. tri istraživačka tima u SAD-u, Kini i Njemačkoj. 1980. godine, danska kompanija Novo Industri razvila je metodu za pretvaranje svinjskog inzulina u ljudski inzulin zamijenivši 30. ostatak alanina u lancu B ostatkom treonina. Oba inzulina se nisu razlikovala u aktivnosti i trajanju djelovanja.
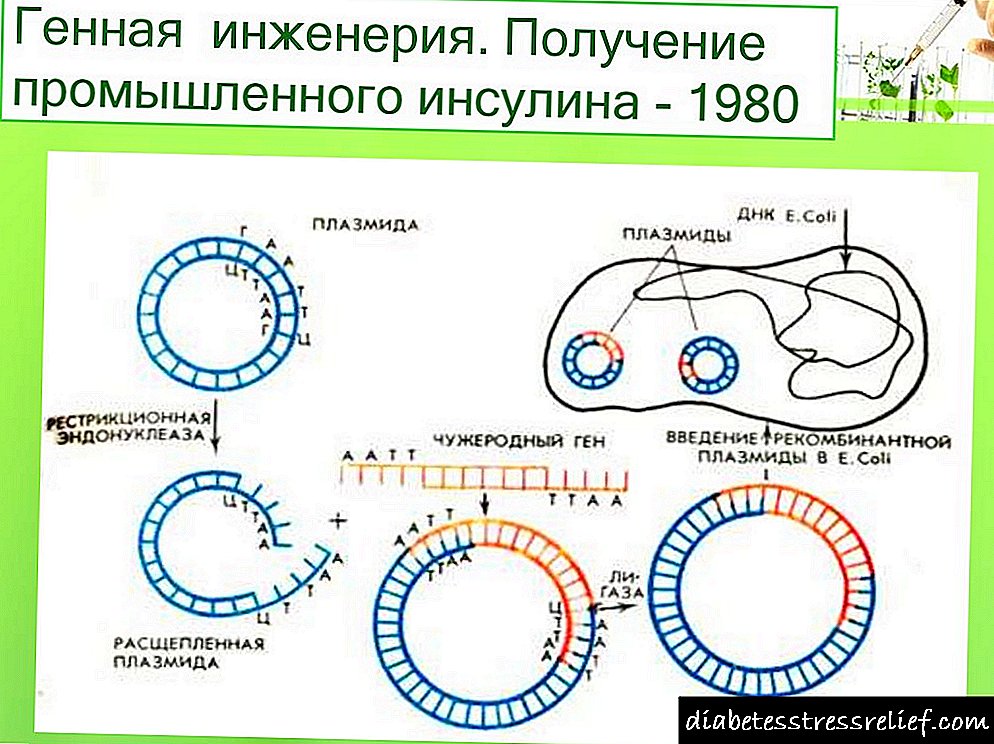
Rad na genetskom inženjeringu inzulina počeo je prije oko 20 godina. 1978. godine pojavila se poruka o proizvodnji soja Escherichia coli koji proizvodi proinzulin štakora (SAD). Iste godine pojedinačni humani lanci inzulina sintetizovani su ekspresijom svojih sintetičkih gena u ćelijama.E.coli(Sl. 5.11). Svaki od dobivenih sintetskih gena podešen je na 3'-kraj enzimskog gena (3-galaktozidaza i uveden u vektorski plazmid(pBR322).ĆelijeE.colitransformisani s takvim rekombinantnim plazmidima, proizvedeni su hibridni (himerni) proteini koji se sastoje od fragmenta p-galaktozidaze i A ili B inzulinskog peptida koji je na nju povezan preko metioninskog ostatka. Prilikom prerade himernog proteina cijanogen bromidom peptid se oslobađa. Međutim, zatvaranje disulfidnih mostova između formiranih lanaca inzulina bilo je teško.
1981. godine sintetizovan je pro-inzulinski analog, mini-C-pro-inzulin, u kojem je 35-jedinica C-peptid zamijenjen segmentom od šest aminokiselina: arg-arg-gly-ser-lys-arg i njegova ekspresija je prikazana uE.coli.
Godine 1980. W. Gilbert i njegovi kolege izolirali su mRNA inzulina iz tumora pankreasne pankreasa štakora i dobili cDNA iz njega koristeći reverznu transkriptazu. Rezultirajuća cDNA je ubačena u plazmidpBR322E.coliu srednjem dijelu gena za penicilinazu. Rekombinantni plazmid sadržavao je podatke o strukturi proinsulina.Kao rezultat prevođenja mRNA, sintetizovan je hibridni protein u ćelijama koje sadrže sekvence penicilinaze i proinzulina, koje su probavljene tripsinom iz takvog proteina.
1978. godine zaposlenici Instituta za organsku hemiju pod nadzorom akad. Yu. A. Ovchinnikov, sintetizirana su dva strukturna gena koji kodiraju sintezu neuropeptida:leucin-enkefalin i bradikinin.Sintetizirani gen lekein enkefalina imao je dva "ljepljiva" kraja:
Nastali sintetički gen ubačen je zajedno s prirodnim fragmentom DNA koji sadrži promotor i proksimalni deo gena proteina E. coli P-galaktozidaze.E.coliplazmidu
Dobivanje inzulina, metode genetskog inženjeringa, biotehnologija - kursevi

1. Struktura i funkcije inzulina 5
1.1. Struktura molekula insulina 5
1.2. Biološki značaj inzulina 7
1.3. Biosinteza inzulina 8
2. Sinteza inzulina genetskog inženjeringa 10
2.1. Primjena metoda genetskog inženjeringa za sintezu lijekova 10
2.2. Metode genetskog inženjeringa 11
2.3. Proizvodnja inzulina genetskog inženjeringa 14
Izvod iz teksta
Uz to, obje ove komponente mogu istovremeno biti prisutne u sastavu hibridnog proteina. Pored toga, pri stvaranju hibridnih proteina može se primijeniti princip višedimenzionalnosti - prisutnost nekoliko kopija ciljnog polipeptida u hibridnom proteinu, što može značajno povećati prinos ciljanog proizvoda.
U Velikoj Britaniji su oba lanca humanog inzulina sintetizirana pomoću E. coli, povezane u molekulu biološki aktivnog hormona. Da bi jednoćelijski organizam mogao sintetizirati molekule inzulina na svojim ribosomima, potrebno mu je opskrbiti ga potrebnim programom, odnosno uvesti u njega gen hormona.
Rekombinantni inzulin dobiven je na Institutu Ruske akademije nauka pomoću genetski inženjerskih sojeva E. coli. Protein hibridnog prekursora se izražava iz uzgojene biomase, izražene u količinama
40. ukupnog ćelijskog proteina koji sadrži prepinsulin.
Njegova pretvaranje u in vitro inzulin provodi se istim redoslijedom kao i in vivo - vodeći polipeptid se cijepa, prepinsulin se pretvara u inzulin fazama oksidativne sulfitolize, nakon čega slijedi reduktivno zatvaranje tri disulfidne veze i enzimska izolacija vezivnog C-peptida. Nakon niza izmjenjivanja iona, gel i HPLC kromatografskim pročišćavanjem, dobiva se humani inzulin visoke čistoće i prirodne aktivnosti.
Za dobivanje inzulina koristi se soj sa nukleotidnom sekvencom umetnutom u plazmid koji eksprimira hibridni protein koji se sastoji od linearnog proinsulina i fragmenta proteina A Staphylococcus aureus pričvršćenog na njegov N-kraj preko ostatka metionina 8, 9, 10.
Uzgoj zasićene biomase ćelija rekombinantnog soja osigurava početak proizvodnje hibridnog proteina, čija izolacija i sekvencijalna transformacija u epruveti dovode do inzulina.
Mogući je i drugi način: dobivanje u bakterijskom sistemu ekspresije rekombinantnog proteina koji se sastoji od ljudskog proinzulina i polihistidina koji je na njega vezan preko metioninskog ostatka. Izolira se pomoću helatne kromatografije na stupcima sa cepanjem Ni-agaroze i broma.
Izolovani protein je S-sulfoniran. Mapiranje i masa spektrometrijske analize dobivenog proinzulina pročišćenog ionskom izmjenjivačkom kromatografijom na anionskoj izmjenjivačkoj smoli i RP (reverzne faze) tekućinske kromatografije visokih performansi pokazuju prisustvo disulfidnih mostova koji odgovaraju disulfidnim mostovima izvornog ljudskog proinzulina.
U posljednje vrijeme pažnja se posvećuje pojednostavljivanju postupka proizvodnje rekombinantnog inzulina genetičkim inženjeringom.Tako, na primjer, možete dobiti protein koji se sastoji od proinzulina vezanog na N-terminusu kroz lizinski ostatak interleukin vođe peptida
2. Protein se efikasno eksprimira i lokalizira u inkluzivnim tijelima. Nakon izolacije, protein za proizvodnju inzulina i C-peptida se razgrađuje tripsinom 5, 8, 10.
Rezultirajući inzulin i C-peptid su pročišćeni RP-HPLC. Veoma značajan pri stvaranju fuzioniranih struktura je omjer masa nosećeg proteina i ciljanog polipeptida.
C-peptidi uz pomoć razmaka aminokiselina koji nose mjesto restrikcije Sfi I i dva ostatka arginina na početku i na kraju razmaka za naknadnu probavu proteinskih tripsina povezani su prema principu head-tail.
HPLC proizvoda cijepanja pokazuje da cijepanje C-peptida provodi kvantitativno, što omogućava upotrebu multimernih sintetskih gena za proizvodnju ciljnih polipeptida u industrijskom obimu.
Zaključak
Radikalni i u većini slučajeva do danas jedini način za održavanje životnog i radnog kapaciteta pacijenata sa šećernom bolešću je inzulin.
Prije primanja i uvođenja inzulina u kliničku praksu, očekivao se smrtni ishod za jednu ili dvije godine od početka bolesti pacijenata s dijabetesom tipa I, uprkos korištenju dijete koje je najslabija.
Pacijentima dijabetesa tipa I potrebna je doživotna zamjenska terapija inzulinskim pripravcima. Prestanak redovite primjene inzulina iz ovih ili drugih razloga dovodi do brzog razvoja komplikacija i brze smrti pacijenta.
Trenutno je prevalencija dijabetesa na trećem mjestu nakon bolesti kardiovaskularnog sustava i malignih tumora. Prevalencija dijabetesa kod odraslih, prema podacima Svjetske zdravstvene organizacije, u većini regija svijeta je 2-5% i ima tendenciju povećanja svakog
1. godine broj pacijenata gotovo se udvostručio. Broj pacijenata koji ovise o insulinu, uprkos očiglednom napretku u oblasti zdravstva, svake godine raste, a trenutno samo u Rusiji iznosi oko 2 miliona ljudi.
Najperspektivnije metode za proizvodnju inzulina su metode genetskog inženjeringa. Genetski modificirani inzulin dobiva se zasebnim proizvodnjom lanaca A i B koristeći različite sojeve proizvođača i naknadnim savijanjem molekula, nakon čega slijedi razdvajanje izoforma i sinteza proinzulina u E. Coli ćelijama s njegovim cijepanjem tripsinom i karboksipeptidazom i proizvodnjom nativnog inzulina.
Stvaranje lijekova domaćeg genetski proizvedenog humanog inzulina otvara nove mogućnosti za rješavanje mnogih problema ruske dijabetologije kako bi se spasili životi miliona ljudi koji imaju dijabetes.
Literatura
Balabolkin M.I., Klebanova E.M., Kreminskaya V.M. Dijabetes melitus: savremeni aspekti dijagnoze i liječenja / Doctor, ed. G.L.
Gavrikov, A.V. Optimizacija biotehnološke proizvodnje supstanci rekombinantnih humanih interferona: dis. ... kandido. biol. Nauke - M, 2003
Genetski inženjerski ljudski inzulin. Povećanje efikasnosti hromatografskog odvajanja pomoću principa bifunkcionalnosti. / Romančikov A.B., Yakimov S.A., Klyushnichenko V.E., Arutunyan A.M., Wulfson A.N. // Bioorganska hemija, 1997. - 23, br. 2
Glick B., Parsnip J. Kontrola upotrebe biotehnoloških metoda // B. Glick, J. Parsnip / Molekularna biotehnologija = Molekularna biotehnologija. - M .: Mir, 2002. - S. 517-532. - 589 str.
Glick B., Pasternak J. Molekularna biotehnologija. Načela i primjena. M .: Mir, 2002.
Davis R., Botstein D, Roth J. Metode genetskog inženjeringa. Genetika bakterija // R. Davis, D. Botstein, J. Roth / Per. s engleskog jezika.-M .: Mir. - 1984.- 176 str.
Ermishin A.P.Genetski modificirani organizmi: mitovi i stvarnost / A. P. Ermishin // Mn .: Tehnalogaliya.- 2004. - 118 str.
Osnove farmaceutske biotehnologije: Udžbenik / TP Prischep, V.S. Chuchalin, K.L. Zaykov, L.K. Mikhaleva. - Rostov na Donu .: Phoenix, Tomsk: Izdavačka kuća NTL, 2006.
Patrushev L. I. Umjetni genetski sustavi. // L. I. Patrushev / M .: Nauka.- 2004.
Romančikov, A.B. Genetski inženjerski ljudski inzulin. Povećanje efikasnosti hromatografskog odvajanja pomoću principa bifunkcionalnosti. / A.B. Romančikov i drugi.
// Bioorganska hemija. 1997. br. 2. str. 23
Rybchin V. N. Osnove genetskog inženjeringa // V. N. Rybchin / 2nd ed., Revidirano. i dodajte: Udžbenik za sveučilišta. SPb .: Izdavačka kuća SPbSTU. - 2002. - 522 s.
Schelkunov S. N. Genetski inženjering // Schelkunov S. N. / Novosibirsk: Sib. univ. Izdavačka kuća, 2008.
Schelkunov, S.N. Genetski inženjering: udžbenik. dodatak. - 2. izd., Otr. i dodaj. - Novosibirsk: Sib. univ. Izdavačka kuća, 2004. - 496 str.
1. Lokacija disulfidnih veza u molekuli inzulina.
2. Raspored aminokiselinskih ostataka u molekuli inzulina
Učinak inzulina na ključne metaboličke enzime
Aktivacija masnog tkiva jetre 1. Fosfodiesteraza 1. Fosfodiesteraza 1. LP-lipaza
4. kompleks piruvat dehidrogenaze
4. kompleks piruvat dehidrogenaze
5. Fosfatazna glikogen sintaza i glikogen fosforilaza
5. Glikogen sintaza fosfataza b. Indukcija acetil-CoA-karboksilaze 1. Glukokinaza 1. Glicerraldehid fosfat dehidrogenaza
6. Glukoza-6-fosfat dehidrogenaza Represija Fosfoenolpiruvat karboksikinaza
Sl. 3 Šema biosinteze insulina u β-ćelijama otočića Langerhansa. ER - endoplazmatski retikulum. 1 - formiranje signalnog peptida, 2 - sinteza predproinsulina, 3 - cijepanje signalnog peptida, 4 - transport proinzulina u Golgijev aparat, 5 - konverzija proinzulina u inzulin i C-peptid i uključivanje inzulina i C-peptida u sekretorne granule, 6 - lučenje inzulina i C peptid.
4. Općenita šema za sintezu inzulina njegovih prethodnika
Sl. 5 Sinteza inzulina stvaranjem dva odvojena lanca
Način dobivanja genskog inženjera humanog inzulina
Izum se odnosi na oblast biotehnologije, a posebno na proizvodnju gensko inženjerskog humanog inzulina za proizvodnju lijekova koji se koriste u liječenju dijabetesa melitusa.
Metoda se provodi uzgajanjem sojeva proizvođača hibridnog proteina koji sadrži ljudski proinzulin, Escherichia coli BL21 / pPINS07 (BL07) ili Escherichia coli JM109 / pPINS07, razbijajući stanice raspadom, razdvajajući inkluzijska tijela koja sadrže hibridni protein.
Zatim se vrši prethodno ispiranje inkluzivnih tijela, istovremeno otapanje proteina i obnavljanje disulfidnih veza u puferu s 5-10 mM ditiotreitola i 1 mM EDTA, renaturacija i pročišćavanje renaturiranog fuzijskog proteina ionskom izmjenom kromatografijom.
Cijepanje hibridnog proteina vrši se zajedničkom hidrolizom tripsina i karboksipeptidaze B u težinskom odnosu hibridnog proteina, tripsina i karboksipeptidaze B 4000: 0,6: 0,9.
Pročišćavanje inzulina vrši se hidrofobnom kromatografijom ili tekućinskom kromatografijom visokih performansi reverzne faze nakon čega slijedi gel filtracija i izolacija inzulina kristalizacijom u prisustvu cinkovih soli. Izum omogućava da se smanji postupak dobijanja gensko inženjerskog humanog inzulina i poveća njegov izlaz.
Izum se odnosi na oblast biotehnologije, a posebno na proizvodnju gensko inženjerskog humanog inzulina za proizvodnju lijekova koji se koriste u liječenju dijabetesa melitusa.
Uzimajući u obzir glavna dostignuća moderne dijabetologije i preporuke Svjetske zdravstvene organizacije, evropske su zemlje do 2001. godine dovršile prijelaz na upotrebu ljudskog inzulina. U tom smislu, razvoj metoda za proizvodnju inzulina primjenom metoda DNA rekombinantne tehnologije predstavlja hitan zadatak.
Poznata metoda za proizvodnju gensko inženjerskog ljudskog inzulina, koja se sastoji u uzgoju soja proizvođača E. Coli koji proizvodi proinzulin, koji sadrži niz dviju sintetskih IgG vežućih domena stafilokoknog proteina A.
Metoda se sastoji u uništavanju bakterijskih stanica, dobivanju inkluzije Bika koja sadrži proinzulin, rastvaranju inkluzije Bika, oksidativnoj sulfitolizi proinzulina, njegovoj renaturaciji, pročišćavanju renaturiranog proteina afinitetnom kromatografijom, cijepanju proinzulina proteolitičkim enzimima (tripsin i karboksipeptidaza B) i konačnom pročišćavanju inzulina uz učinkovito pročišćavanje inzulina uz efikasno pročišćavanje inzulina uz učinkovito efikasno pročišćavanje inzulina kromatografija (Nilson J., Jonasson P., Samuelsson E., Stahl S., Uhlen M. "Integrirana proizvodnja ljudskog inzulina i njegovog C-peptida", Journal of biotechnology, 1996, v. 48, str. 241-250) .
Nedostaci ove metode su visoka cijena proizvoda i upotreba u proizvodnji deterdženta za inzulin koji mogu biti prisutni u ciljnom proizvodu.
Poznata metoda proizvodnje gensko inženjerskog ljudskog inzulina koja se sastoji u kultiviranju stanica proizvođačkog soja E.
Coli DN5 a / pVK100, uništavaju bakterijske ćelije ultrazvučnom dezintegracijom, odvajaju inkluzijska tijela koja sadrže hibridni protein iz nerastvorljivih nečistoća centrifugiranjem, rastvaraju se inkluzijska tijela u puferu koji sadrži 8 M urea, 1 mM ditiotreitol, 0,1 M Tris-HCl, pH 8,0, tokom 12-16 sati.
Nerastvorljive nečistoće uklanjaju se centrifugiranjem, nakon čega se koncentracija ditiotreitola povećava na 10 mM i disulfidne veze se 1 sat vraćaju na 37 ° C. Otopina je razblažena 5 puta hladnom vodom, podešena na pH 4,5 i inkubirana tokom 2 sata na 4 ° C da bi nastao talog.
Talog koji sadrži hibridni protein izdvojen je centrifugiranjem i renaturiran, brzo otopljen u hladnoj vodi pri pH od 10-12, nakon čega je razrijeđen sa 10 mM puferom glicina, pH 10,8, i čuvan preko noći na 4 ° C. Nakon ultrafiltracije, rastvor je podvrgnut gel filtraciji na koloni Sephadex G-50 i eluiran sa 10 mM glicin puferom.
Frakcije koje sadrže fuzijski protein se sakupljaju, ultrafiltriraju i liofiliziraju. Rezultirajući fuzijski protein rastvoren je u 0,08 M Tris-HCl puferu, pH 7,5, do koncentracije 10 mg / ml, i odcijepljen istovremeno s tripsinom i karboksipeptidazom B (omjer karboksipeptidaze B: tripsin: fuzijski protein 0,3: 1: 10) na 37 ° C tokom 30 minuta.
Zatim dodajte izopropanol na 40%. Smjesa se kromatografira na stupcu DEAE-Sephadex A-25 i eluira sa 0,05 M Tris-HCl puferom, pH 7,5 sa 40% izopropanola s linearnim gradijentom natrijum-klorida od 0 do 0,1 m. Nakon uklanjanja izopropanola koncentracija natrijum-hlorida povećati na 25%, pomaknuti pH na 2,0 i prikupiti talog inzulina.
(Chen J.-Q., Zhang H.-T., Hu M.-N., Tang J.-G., "Proizvodnja humanog inzulina u sistemu E. Coli sa met-li-ljudskim proinzulinom kao izraženim preteča "Primenjena biohemija i biotehnologija, 1995, st. 55, str. 5-15).
Nedostaci ove metode uključuju uporabu gel filtracije u početnim fazama, koja zahtijeva značajne količine sorbenta i veliki broj enzima koji se koriste u cijepanju hibridnog proteina.
Poznata metoda za proizvodnju gensko inženjerskog ljudskog inzulina, uključujući kultiviranje proizvodnog soja Escherichia coli JM109 / pPINS07, uništavanje bakterijskih stanica dezintegracijom, odvajanje inkluzivnih tijela koja sadrže hibridni protein, rastvaranje u puferu koji sadrži ureu i ditiotritol, renaturiranje i pročišćavanje renaturiranog hibridiziranog proteina taloženje nečistoćih spojeva u 40% izopropanolu nakon čega slijedi kromatografija na KM-sefarozi, njeno sekvencijalno cijepanje tripsinom i karboksipeptidazom B, dok proizvodi triptozinoliza se kromatografira na SP-Sefarozi, uravnoteženo sa 0,03-0,1 M puferom amonijum acetata pH 5,0-6,0 koji sadrži 6 M urea, uz eluciju proteina s linearnim gradijentom natrijum-hlorida od 0 do 0,5 M u početnom pufer, a frakcija inzulina dobivena nakon cijepanja s karboksipeptidazom B pročišćena je tekućinskom kromatografijom visokih performansi reverzne faze (RP HPLC), a potom filtriranjem gelom (patent br. 2141531, MKI C12P 21/02, publ. 1999)
Nedostaci metode uključuju upotrebu značajnih količina uree i organskih otapala u fazi pročišćavanja hibridnog proteina.
Stručnjak za dijabetes

Prije upotrebe inzulina, životni vijek bolesnika sa šećernom bolešću bio je ne više od 10 godina. Izumom ovog lijeka spasili su milione pacijenata. Ljudski genetski inženjering inzulina je najnoviji napredak u nauci.
Rezultat dugogodišnjeg napornog rada
Prije izuma preparata genetskog inženjeringa (rekombinantnog), inzulin je izoliran iz gušterače goveda i svinja.
Razlika između svinjskog inzulina i humanog je samo jedna aminokiselina
Nedostaci ove metode dobijanja leka:
- složenost skladištenja i transporta bioloških sirovina,
- nedostatak stoke
- poteškoće povezane sa izdvajanjem i pročišćavanjem hormona pankreasa,
- visok rizik od alergijskih reakcija.
Sintezom prirodnog ljudskog inzulina u bioreaktoru 1982. godine započelo je novo biotehnološko doba. Ako je u zoru terapije inzulinom cilj naučnika bio samo preživljavanje pacijenta, u naše vrijeme razvoj novih lijekova ima za cilj postizanje održive nadoknade bolesti. Glavni cilj znanstvenog istraživanja je poboljšanje kvalitete života pacijenta s dijabetesom.
Savremena tehnologija
Vrste lijekova, ovisno o načinu pripreme:
| Rekombinantni genetski inženjering | Za proizvodnju se koristi genetski modificirana E. coli.
| Omiljeni od genetičara je E. coli |
| Genetski modifikovana | Polazni materijal je inzulin svinje. Modificirano je metodom genetskog inženjeringa. | Struktura hormona |
| Sintetički | Umjetno sintetizirani lijek, po svom sastavu potpuno je identičan ljudskom inzulinu. | Proizvodnja lijekova |
Šta se događa u tijelu nakon primjene lijekova?
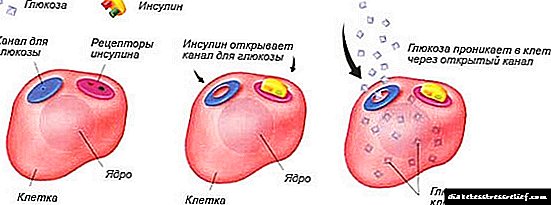
Spajajući se sa receptorom ćelijske membrane, insulin formira kompleks koji sprovodi sledeće procese:
- Poboljšava intracelularni transport glukoze i olakšava njegovu apsorpciju.
- Potiče oslobađanje enzima koji su uključeni u preradu glukoze.
- Smanjuje stopu stvaranja glikogena u jetri.
- Potiče metabolizam masti i proteina.
U slučaju supkutane primjene, inzulin počinje djelovati za 20-25 minuta. Trajanje lijeka od 5 do 8 sati. Dalje se odvaja enzimom insulinazom i izlučuje u urinu. Lijek ne prelazi preko placente i ne prelazi u majčino mlijeko.
Kada se propisuje genetski inzulin?
Ako je potrebna hitna pomoć
Genetski inženjerski ljudski inzulin koristi se u sljedećim slučajevima:
- Dijabetes tipa 1 ili 2. Koristi se kao neovisno liječenje ili u kombinaciji s drugim lijekovima.
- Sa rezistencijom na oralne hipoglikemijske agense.
- Sa dijabetesom u trudnica.
- U slučaju komplikacija s bubrezima i jetrom.
- Pri prelasku na inzulin s produljenim djelovanjem.
- U predoperativnom periodu.
- U slučaju opasnih stanja (hiperosmolarna ili ketoacidotska koma).
- U hitnim situacijama (prije porođaja, s ozljedama).
- Ako postoje distrofične lezije kože (čirevi, furunculosis).
- Liječenje dijabetesa na pozadini infekcije.
Ljudski genetski inženjering inzulina se dobro podnosi i ne izaziva alergijske reakcije, jer je potpuno identičan prirodnom hormonu.
Konstantno praćenje je važno!
Zabranjeno je propisivanje lijekova u slučaju:
- snižavanje šećera u krvi
- preosjetljivost na lijek.
U prvim danima nakon imenovanja lijeka potrebno je pažljivo praćenje pacijenta.
Nuspojave
Urticaria Opasnost! Quinckeov edem!
U rijetkim slučajevima, kada koristite inzulin, moguće su sljedeće komplikacije:
- alergijske reakcije (urtikarija, Quinckeov edem, svrbež kože),
- nagli pad šećera u krvi (razvija se zbog odbacivanja lijeka od strane tijela ili u slučaju imunološkog sukoba),
- oslabljena svest
- u težim slučajevima moguć je razvoj hipoglikemijske kome.
- žeđ, suha usta, letargija, gubitak apetita,
- hiperglikemija (kada se lek koristi protiv pozadine infekcije ili groznice),
- crvenilo lica
- lokalne reakcije u području primjene (spaljivanje, svrbež, atrofija ili proliferacija potkožnog masnog tkiva).
Ponekad prilagođavanje lijeku prate i poremećaji poput oticanja i oštećenja vida. Ove manifestacije obično nestaju nakon nekoliko nedelja.
Kako u ljekarni pronaći genetski modificirani inzulin?
Lijek je dostupan u obliku otopine za parenteralnu primjenu:
| "Biosulin" | Prosječno trajanje akcije |
| Actrapid | Insulin kratkog djelovanja |
| Gensulin | Dvofazni preparat (kombinacija kratkotrajnih i srednjih inzulina) |
| Rinsulin | Brzi efekat |
| Humalog | Olovka za špricu koristi se za administraciju leka. |
Nije teško odabrati pripravak inzulina uzimajući u obzir individualne karakteristike pacijenta.
Uslovi korišćenja
Najčešće se koristi subkutana primjena inzulina.
U hitnim slučajevima lijek se daje intravenski.
U teškom stanju pacijenta
Čak i dijabetičar sa iskustvom može pogriješiti tijekom upotrebe lijeka.
Da bi se izbjegle komplikacije, potrebno je:
- Prije upotrebe provjerite datum isteka lijeka.
- Pridržavajte se preporuka za skladištenje: Rezervne bočice čuvajte u hladnjaku. Razvijena bočica može se čuvati na sobnoj temperaturi u tamnom mjestu.
- Obavezno zapamtite ispravnu dozu: ponovo pročitajte recept liječnika.
- Prije ubrizgavanja, obavezno je oslobađanje zraka iz špriceva.
- Koža treba biti čista, ali je za preradbu nepoželjno koristiti alkohol, jer smanjuje učinkovitost lijeka.
- Odaberite najbolje mjesto za injekcije. Kada se unese pod kožu trbuha, lijek će djelovati brže. Sporija apsorpcija inzulina kada se uvede u glutealni nabor ili rame.
- Koristite cijelu površinu (prevencija lokalnih komplikacija). Razmak između injekcija treba biti najmanje 2 cm.
- Uhvatite kožu u nabora kako biste umanjili rizik od ulaska u mišić.
- Ubrizgajte špricu ispod kože pod kutom, tako da lek ne curi.
- Kada se ubrizga u želudac, inzulin kratkog djelovanja daje se 20 minuta prije obroka. U slučaju izbora ramena ili stražnjice - trideset minuta prije obroka.
Kombinacija s drugim lijekovima
Često s dijabetesom pacijent uzima nekoliko lijekova. Kombinacija s drugim lijekovima može utjecati na terapeutski učinak genetski inzulinskog inzulina.
Da biste spriječili komplikacije, morate znati:
| Povećajte učinak genetski inzulinskog inzulina snižavanjem šećera u krvi |
| Popularni lijek koji se koristi u liječenju infekcija mokraćnih puteva Doxycycline |
| Smanjite djelovanje inzulina |
| Diuretik |
Predoziranje
U nekim slučajevima primjena inzulina dovodi do naglog smanjenja šećera u krvi. Problem se često javlja zbog nepravilnog odabira doze.
Početni simptomi hipoglikemije:
- slabost
- blijedost kože
- anksiozno stanje
- vrtoglavica
- dezorijentacija
- ukočenost ruku, nogu, jezika i usana,
- drhtavi udovi
- hladan znoj
- snažan osjećaj gladi
- glavobolje.
Tremor; naglo pogoršanje blagostanja
Ako primjećujete takve simptome u sebi, morate brzo pojesti nešto što sadrži lako probavljive ugljikohidrate. To mogu biti kolačići, bomboni, komad šećera ili bijeli hljeb. Slatki čaj pomaže u takvim situacijama.
Ako se stanje pogorša, morate pozvati hitnu pomoć. Hipoglikemija može rezultirati komom ili smrću pacijenta.
Je li rekombinantni inzulin opasan?
Zdravo Rekombinantni inzulin se ne razlikuje od prirodnog. Da bi se dobilo koriste se genetski modificirane bakterije.
Koristeći tehnologije genetskog inženjeringa, rekombinantna DNK koja sadrži gen insulina implantirana je u ćeliju E. coli. Genetski modificirani organizmi se množe i proizvode hormon. Lijek je veoma efikasan i ima visok stepen pročišćavanja.
Inzulin II deo Mikrobiološka proizvodnja inzulina

komponenta afiniteta - značajno olakšava izolaciju hibridnog proteina.
U tom slučaju obje ove komponente mogu istovremeno biti prisutne u sastavu hibridnog proteina.
Pored toga, pri stvaranju hibridnih proteina može se primijeniti princip višedimenzionalnosti (to jest, nekoliko kopija ciljnog polipeptida je prisutno u hibridnom proteinu), što može značajno povećati prinos ciljanog proizvoda.
2 Izražavanje proinzulina u ćelijama E. coli ..
U radu su autori koristili soj JM 109 N1864 sa nukleotidnom sekvencom umetnutom u plazmid koji eksprimira hibridni protein, koji se sastoji od linearnog proinzulina i fragmenta proteina A Staphylococcus aureus pričvršćenog na njegov N-kraj preko ostatka metionina.
Uzgoj zasićene biomase ćelija rekombinantnog soja osigurava početak proizvodnje hibridnog proteina, čija izolacija i sekvencijalna transformacija u epruveti dovode do inzulina.
Druga grupa istraživača dobila je rekombinantni protein u bakterijskom sistemu ekspresije fuzije koja se sastojala od ljudskog proinzulina i polihistindinog repa pričvršćenog na njega preko ostatka metionina. Izolovana je korišćenjem helatne hromatografije na stupcima Ni-agaroze iz inkluzivnih tela i digestirana cijanogen bromidom.
Mapiranje i masa spektrometrijske analize dobivenog proinzulina pročišćenog ionskom izmjenjivačkom kromatografijom na anionskoj izmjenjivačkoj smoli i RP (reverzna faza) HPLC (tekuća kromatografija visoke performanse) pokazali su prisustvo disulfidnih mostova koji odgovaraju disulfidnim mostovima nativnog ljudskog proinzulina. U radu se izveštava o razvoju nove, poboljšane metode za proizvodnju ljudskog insulina genetskim inženjeringom u prokariotskim ćelijama. Autori su otkrili da je rezultirajući inzulin po svojoj strukturi i biološkoj aktivnosti identičan hormonu izoliranom iz gušterače.
U posljednje vrijeme pažnja se posvećuje pojednostavljivanju postupka proizvodnje rekombinantnog inzulina genetičkim inženjeringom. Dakle, autori su dobili fuzijski protein koji se sastojao od vodećeg peptida interleukina 2 vezanog na N-kraj proinzulina preko lizinskog ostatka.
Protein je efikasno eksprimiran i lokaliziran u inkluzivnim tijelima. Nakon izolacije, protein se probavlja s tripsinom da bi se stvorio inzulin i C-peptid. Druga grupa istraživača ponašala se na sličan način.
Fuzijski protein koji se sastoji od proinsulina i dvije sintetičke domene stafilokoka IgG koji vezuje protein bio je lokaliziran u inkluzijskim tijelima, ali imao je višu razinu ekspresije. Protein je izolovan afinitetnom kromatografijom upotrebom IgG i prerađen tripsinom i karboksipeptidazom B.
Rezultirajući insulin i C-peptid su pročišćeni RP HPLC. Pri stvaranju fuzionisanih struktura, omjer mase proteinskog nosača i ciljanog polipeptida je vrlo značajan.
Dakle, rad opisuje izgradnju fuzijskih struktura, gdje je albuminski humani albumin u serumu korišten kao nosivi polipeptid. Na njega su bili prikačeni jedan, tri i sedam C-peptida.
C-peptidi su povezani na osnovi glave-repa koristeći razmake aminokiselina koji nose Sfi I restrikcijsko mjesto i dva ostatka arginina na početku i na kraju razmaka za kasnije dijeljenje proteina s tripsinom. HPLC proizvoda cijepanja pokazao je da je cijepanje C-peptida kvantitativno, što omogućava korištenje multimernih sintetičkih gena za dobivanje ciljanih polipeptida u industrijskom obimu.
Rad opisuje pripremu proinsulinskog mutanta, koji je sadržavao zamjenu Arg32Tyr-a. Kada se ovaj protein ko-cepirao sa tripsinom i karboksipeptidazom B, nastali su nativni inzulin i C-peptid koji sadrži ostatak tirozina. Potonji se, nakon označavanja 125I, aktivno koristi u radioimunološkom ispitivanju. 3 Pročišćavanje inzulina.
Inzulin namijenjen proizvodnji lijekova mora biti visoke čistoće. Stoga je neophodna visoko efikasna kontrola čistoće proizvoda dobivenih u svakoj fazi proizvodnje. Ranije su HPLC RP i IO (izmjena jona) korišteni za karakterizaciju proinsulin-S-sulfonata, proinzulina, pojedinačnih A- i B-lanaca i njihovih S-sulfonata.
Posebna se pažnja posvećuje i fluorescentnom derivatu inzulina. U radu su autori istražili primjenjivost i informativnost kromatografskih metoda u analizi proizvoda u svim fazama proizvodnje humanog inzulina i izradili raspored kromatografskih operacija kako bi se učinkovito odvojili i karakterizirali dobiveni proizvodi.
Osim toga, razvijaju se pristupi za automatizaciju i ubrzavanje procesa za određivanje čistoće i količine inzulina.
U radu su iznesene studije o mogućnosti korišćenja RP tečne hromatografije s elektrohemijskim otkrivanjem za određivanje inzulina i razvijena je metodologija za određivanje insulina izoliranog s otoka Langerhansa imunoafinitetnom kromatografijom sa spektrometrijskom detekcijom.
U radu je istražena mogućnost upotrebe brzog mikroodređenja inzulina pomoću kapilarne elektroforeze sa detekcijom laserske fluorescencije. Analiza se vrši dodavanjem uzorku poznate količine inzulina označene fenilistiotiocijanatom (FITC) i Fab fragmenta monoklonalnih inzulinskih antitijela. Označene i redovne insuline konkurentno reagiraju s kompleksom Fab. FITZ-označeni inzulin i njegov kompleks sa Fab odvajaju se za 30 sekundi.
U posljednje vrijeme, veliki broj radova posvećen je poboljšanju metoda za proizvodnju inzulina, kao i stvaranju oblika doziranja na temelju njega.
Na primjer, u SAD su patentirani hepatospecifični analozi inzulina, strukturno različiti od prirodnog hormona zbog unošenja različitih aminokiselinskih ostataka na položajima 13-15 i 19 lanca A i na položaju 16 lanca B.
Dobiveni analozi koriste se u različitim parenteralnim (intravenski, intramuskularni, potkožni), intranazalni oblici doziranja ili implantacija u obliku posebnih kapsula za liječenje dijabetesa melitusa. Od posebne važnosti je stvaranje oblika doziranja koji se primjenjuju bez injekcija.
U radu se izveštava o stvaranju makromolekularnog sistema za oralnu administraciju, koji je insulin imobilizovan u volumenu polimernog hidrogela modifikovanog inhibitorima proteolitičkih enzima. Učinkovitost takvog lijeka je 70-80% od efikasnosti supkutano unesenog urođenog inzulina.
U drugom djelu, lijek se dobija jednostupnom inkubacijom inzulina sa crvenim krvnim ćelijama, uzet u omjeru 1-4: 100, u prisustvu sredstva za vezanje.Autori izvještavaju o primanju lijeka s djelovanjem od 1000 jedinica / g, potpuno očuvanjem aktivnosti nakon oralne primjene i skladištenjem nekoliko godina u liofiliziranom obliku.
Osim stvaranja novih lijekova i oblika doziranja na temelju inzulina, razvijaju se i novi pristupi za rješavanje problema dijabetesa.
Dakle, autori su transficirali GLUT2 transporter glukozom cDNA, prethodno stabilno transficiranom cDNA pune veličine inzulina HEP G2 ins ćelija.
U dobivenim HEP G2 Insgl klonovima glukoza stimulira blizu normalne sekrecije inzulina i potencira sekretorni odgovor na ostale stimulanse sekrecije.
Imunoelektronskom mikroskopijom otkrivene su granule koje sadrže insulin, morfološki slične granulama u b-ćelijama otoka Langerhans. Mogućnost upotrebe „umjetne b-ćelije“ dobivene metodama genetskog inženjeringa za liječenje šećerne bolesti tipa 1 trenutno se ozbiljno raspravlja.
Uporedo sa rješavanjem praktičnih problema, izučavaju se i mehanizmi djelovanja inzulina, kao i strukturalni i funkcionalni odnosi u molekuli. Jedna od metoda istraživanja je stvaranje različitih derivata inzulina i proučavanje njihovih fizičko-hemijskih i imunoloških svojstava 23, 24.
Kao što je gore spomenuto, niz postupaka za proizvodnju inzulina zasnovan je na dobivanju ovog hormona u obliku prekursora (proinsulina), nakon čega slijedi enzimsko cijepanje na inzulin i C-peptid. Trenutno je pokazano prisustvo biološke aktivnosti za C-peptid, što omogućava njegovo korištenje u terapeutske svrhe zajedno sa inzulinom.
U sljedećim člancima ove serije razmotrit će se fizikalno-kemijska i biološka svojstva C-peptida, kao i metode za njegovu pripremu.
Biotehnologija u proizvodnji lijekova
Interesantna su kretanja za dobijanje 20K verzije STGh. Obećavajući zadatak je dobivanje i proučavanje ne samo različitih oblika STH-a, nego i imobiliziranih STH-a kako bi se dobilo produženo djelovanje hormona. Razvijena je originalna metoda za dobivanje imobiliziranog STHch-a s produljenim djelovanjem.
Paralelno s proizvodnjom STH-a, stvorena je originalna integrirana tehnologija za proizvodnju hormona adenohipofize, uključujući sve one koji su specifični za vrste i neke njihove modifikacije iz GST-a. Od velike važnosti je provedba ciljanog programa za stvaranje terapijskog lijeka STH (somatogen), dobivenog genetskim inženjeringom.
Kliničko iskustvo je pokazalo da je, optimizirajući liječenje kaskade, u arsenalu poželjno imati nekoliko sličnih farmaceutskih preparata dobivenih različitim tehnologijama ili čak metodama (MF, Ausomatin, Somatogen).
Dugotrajno lečenje (godinama) jednim preparatom STHh uzrokuje smanjenje osjetljivosti u njemu u tijelu.
Dijelom je to možda rezultat stvaranja antitijela, ali glavni razlog mora biti tražen na nivou receptora i procesuiranju hormona.
Rad sa GST-om, kao i sveobuhvatne studije izlučenih hormona i njihovih različitih oblika omogućavaju proučavanje sistema koje je stvorila priroda i bolje ih razumjeti. Postojanje različitih urođenih oblika STH u tijelu ukazuje na njihovu izvedivost i moguću upotrebu, na primjer, u klinici.
Pri stvaranju novih STHch preparata potrebno je prije svega usredotočiti se na prirodne prirodne oblike hormona i, ako je prikladno, skalirati ih genetskim inženjeringom, kao što je učinjeno sa STHch monomerom.
U proizvodnji STHch preparata iz GST-a uspješno se primjenjuje sveobuhvatna industrijska tehnologija za proizvodnju drugih hormona adenohipofize (LGH, FSHch, TTGch i drugi). Potrebno je optimizirati proizvodnju uvođenjem novih naprednih metoda (afinitetna kromatografija itd.
), primaju visoko čiste hormone koristeći integrisanu tehnologiju.
Potrebno je proširiti proizvodnju i upotrebu setova imunomikroanalize hormona adenohipofize za dijagnostiku i biotehnologiju, izvršiti reguliranu proizvodnju standardiziranih antitijela različitih razmjera, stvoriti nove STHch pripravke, uključujući i imobilizirane.
Činjenica da STH utječe na metabolizam proteina, masti i minerala, djeluje na staničnoj razini bez ciljnog organa i predstavlja anabolik, daje velike izglede za njegovu upotrebu za poticanje procesa popravljanja i liječenja različitih bolesti. Šira studija ovih pitanja, kao i mogućnost korištenja različitih modificiranih oblika i varijanti STGch, hitan je i obećavajući zadatak.
Dobivanje inzulina u biotehnologiji
Inzulin, peptidni hormon otočića Langerhansa gušterače, glavni je tretman dijabetesa. Ova bolest je uzrokovana nedostatkom inzulina i manifestuje se povećanjem glukoze u krvi. Donedavno je insulin dobijao iz gušterače bika i svinje.
Lijek se razlikovao od humanog inzulina po 1-3 supstitucija aminokiselina, tako da je postojala prijetnja alergijskih reakcija, naročito kod djece. Široku terapijsku upotrebu inzulina ograničila je njegova velika cijena i ograničeni resursi.
Hemijskim modifikacijama inzulin iz životinja je učinjen nerazlučivim od ljudskog, ali to je značilo dodatni rast cijena proizvoda.
Od 1982. godine, EliLilly proizvodi genetski inzulinski inzulin zasnovan na odvojenoj sintezi lanca E. coli A i B. Trošak proizvoda značajno je smanjen, dobiveni inzulin identičan je ljudskom. Od 1980. godine u štampi se pojavljuju izvještaji o kloniranju gena proinsulina, hormonskog prekursora koji se transformira u zreli oblik s ograničenom proteolizom.
Tehnologija kapsulacije takođe se primenjuje za lečenje dijabetesa: ćelije gušterače u kapsuli, koje se jednom unose u pacijentovo telo, proizvode inzulin tokom godine.
Integrated Genetics lansirala je hormone koji stimulišu folikule i luteinizirajuće hormone. Ti se peptidi sastoje od dvije podjedinice. Na dnevnom redu je industrijska sinteza oligopeptidnih hormona nervnog sistema - enkefalini, izgrađeni iz 5 aminokiselinskih ostataka, i endorfini, analozi morfija.
Ako se racionalno koriste, ti peptidi ublažavaju bol, stvaraju dobro raspoloženje, povećavaju efikasnost, usredotočuju pažnju, poboljšavaju pamćenje i dovode u red san i budnost.
Primjer uspješne primjene metoda genetskog inženjeringa je sinteza p-endorfina upotrebom tehnologije hibridnih proteina gore opisane za drugi peptidni hormon, somatostatin.
Metode za proizvodnju humanog inzulina:
Povijesno, prvi način dobivanja inzulina u terapeutske svrhe je izolacija analoga ovog hormona iz prirodnih izvora (otočića gušterače goveda i svinja).
U 20-im godinama prošlog stoljeća otkriveno je da goveđi i svinjski inzulini (koji su po strukturi i nizu aminokiselina najbliži ljudskom inzulinu) pokazuju aktivnost u ljudskom tijelu usporedivu s ljudskim inzulinom. Nakon toga, bikov ili svinjski inzulin korišten je za liječenje pacijenata s dijabetesom tipa I.
Međutim, nakon nekog vremena pokazalo se da se u nekim slučajevima antitijela na goveđi i svinjski inzulin počinju nakupljati u ljudskom tijelu, a na taj način negiraju njihovo djelovanje.
S druge strane, jedna od prednosti ove metode dobivanja inzulina je dostupnost sirovina (goveđi i svinjski inzulin mogu se lako dobiti u velikim količinama), koji su igrali presudnu ulogu u razvoju prve metode za proizvodnju ljudskog inzulina.Ova metoda se naziva polusintetička.
U ovoj metodi proizvodnje ljudskog inzulina, svinjski inzulin korišten je kao sirovina. C-terminalni oktapeptid lanca B odcijepljen je od pročišćenog svinjskog inzulina, nakon čega je sintetiziran C-terminalni oktapeptid humanog inzulina.
Tada je hemijski povezan, uklonjene su zaštitne skupine i pročišćen je dobiveni inzulin. Prilikom ispitivanja ove metode dobivanja inzulina prikazan je potpuni identitet hormona dobivenog ljudskim insulinom.
Glavni nedostatak ove metode je visoka cijena rezultiranog inzulina (čak i sada je kemijska sinteza oktapeptida skupo zadovoljstvo, posebno u industrijskom smislu).
Trenutno se ljudski inzulin uglavnom dobija na dva načina: modifikacijom svinjskog inzulina sintetičko-enzimatskom metodom i metodom genetskog inženjeringa.
U prvom slučaju metoda se temelji na činjenici da se svinjski inzulin razlikuje od humanog inzulina u jednoj zamjeni na C-kraju lanca Ala30Thr B.
Zamjena alanina treoninom provodi se enzimski kataliziranim cijepanjem alanina i dodavanjem treoninskog ostatka zaštićenog karboksi skupinom umjesto njega, koji je prisutan u velikom višku u reakcijskoj smjesi. Nakon cijepanja zaštitne O-terc-butilne skupine dobiva se humani inzulin.
Inzulin je prvi protein dobiven u komercijalne svrhe pomoću rekombinantne DNK tehnologije. Postoje dva glavna pristupa za proizvodnju ljudskog inzulina genetički izrađenog.
U prvom se slučaju dobivaju odvojena (različiti sojevi proizvođača) za oba lanca nakon čega slijedi savijanje molekula (stvaranje disulfidnih mostova) i odvajanje izoforma.
U drugom, proizvodnja u obliku prekursora (proinsulina) nakon čega slijedi enzimska probava tripsinom i karboksipeptidazom B u aktivni oblik hormona.
Trenutno je najpoželjnije dobiti inzulin u obliku prekursora, koji osigurava pravilno zatvaranje disulfidnih mostova (u slučaju zasebne pripreme lanaca, provode se uzastopni ciklusi denaturacije, razdvajanje izoforma i renaturacija).
S oba pristupa moguće je i pojedinačno dobiti početne komponente (A- i B-lanci ili proinsulin), i kao dio hibridnih proteina. Osim lanca A i B ili proinzulina, hibridni proteini mogu sadržavati:
1) proteinski nosač - obezbeđuje transport hibridnog proteina u periplazmatski prostor ćelije ili medijuma za kulturu,
2) komponenta afiniteta - značajno olakšava izolaciju hibridnog proteina.
U tom slučaju obje ove komponente mogu istovremeno biti prisutne u sastavu hibridnog proteina. Pored toga, pri stvaranju hibridnih proteina može se primijeniti princip višedimenzionalnosti (to jest, nekoliko kopija ciljnog polipeptida je prisutno u hibridnom proteinu), što može značajno povećati prinos ciljanog proizvoda.
Ekspresija proinzulina u stanicama E. coli ..
U radu je korišten soj JM 109 N1864 sa nukleotidnom sekvencom koji eksprimira fuzijski protein, koji se sastoji od linearnog proinzulina i proteina Staphylococcus aureus.
Uzgoj zasićene biomase ćelija rekombinantnog soja osigurava početak proizvodnje hibridnog proteina, čija izolacija i sekvencijalna transformacija u epruveti dovode do inzulina.
Druga grupa istraživača dobila je rekombinantni protein u bakterijskom sistemu ekspresije fuzije koja se sastojala od ljudskog proinzulina i polihistindinog repa pričvršćenog na njega preko ostatka metionina. Izolovana je korišćenjem helatne hromatografije na stupcima Ni-agaroze iz inkluzivnih tela i digestirana cijanogen bromidom.
Mapiranje i masa spektrometrijske analize dobivenog proinzulina pročišćenog ionskom izmjenjivačkom kromatografijom na anionskoj izmjenjivačkoj smoli i RP (reverzna faza) HPLC (tekuća kromatografija visoke performanse) pokazali su prisustvo disulfidnih mostova koji odgovaraju disulfidnim mostovima nativnog ljudskog proinzulina. Takođe se navodi da se razvija nova, poboljšana metoda za proizvodnju ljudskog insulina genetskim inženjeringom u prokariotskim ćelijama. Autori su otkrili da je rezultirajući inzulin po svojoj strukturi i biološkoj aktivnosti identičan hormonu izoliranom iz gušterače.
U posljednje vrijeme pažnja se posvećuje pojednostavljivanju postupka proizvodnje rekombinantnog inzulina genetičkim inženjeringom. Tako je dobijen fuzijski protein koji se sastoji od vodećeg peptida interleukina vezanog na N-kraj proinzulina preko lizinskog ostatka. Protein je efikasno eksprimiran i lokaliziran u inkluzivnim tijelima.
Nakon izolacije, protein se probavlja s tripsinom da bi se stvorio inzulin i C-peptid. Druga grupa istraživača ponašala se na sličan način. Fuzijski protein koji se sastoji od proinsulina i dvije sintetičke domene stafilokoka IgG koji vezuje protein bio je lokaliziran u inkluzijskim tijelima, ali imao je višu razinu ekspresije.
Protein je izolovan IgG afinitetnom kromatografijom i digestiran tripsinom i karboksipeptidazom B. Rezultirajući insulin i C-peptid su prečišćeni RP HPLC. Pri stvaranju fuzionisanih struktura, omjer mase proteinskog nosača i ciljanog polipeptida je vrlo značajan.
Opisana je konstrukcija fuzijskih konstrukata gdje se humani protein za vezanje albumina u serumu koristi kao nosivi polipeptid. Na njega su bili prikačeni jedan, tri i sedam C-peptida.
C-peptidi su povezani na osnovi glave-repa koristeći razmake aminokiselina koji nose Sfi I restrikcijsko mjesto i dva ostatka arginina na početku i na kraju razmaka za kasnije dijeljenje proteina s tripsinom. HPLC proizvoda cijepanja pokazao je da je cijepanje C-peptida kvantitativno, što omogućava korištenje multimernih sintetičkih gena za dobivanje ciljanih polipeptida u industrijskom obimu.
Dobijanje mutiranog proinsulina, koji je sadržavao zamjenu Arg32Tyr-a. Kada se ovaj protein ko-cepirao sa tripsinom i karboksipeptidazom B, nastali su nativni inzulin i C-peptid koji sadrži ostatak tirozina. Potonji se, nakon označavanja 125I, aktivno koristi u radioimunološkom ispitivanju.
Inzulin namijenjen proizvodnji lijekova mora biti visoke čistoće. Stoga je neophodna visoko efikasna kontrola čistoće proizvoda dobivenih u svakoj fazi proizvodnje. Ranije su HPLC RP i IO (izmjena jona) korišteni za karakterizaciju proinsulin-S-sulfonata, proinzulina, pojedinačnih A- i B-lanaca i njihovih S-sulfonata.
Posebna se pažnja posvećuje i fluorescentnom derivatu inzulina. U radu su autori istražili primjenjivost i informativnost kromatografskih metoda u analizi proizvoda u svim fazama proizvodnje humanog inzulina i izradili raspored kromatografskih operacija kako bi se učinkovito odvojili i karakterizirali dobiveni proizvodi.
Osim toga, razvijaju se pristupi za automatizaciju i ubrzavanje procesa za određivanje čistoće i količine inzulina.
Izvještene su studije o mogućnosti korištenja tekuće kromatografije RP-a s elektrohemijskim otkrivanjem za određivanje inzulina, a razvijena je metodologija za određivanje inzulina izoliranog s otoka Langerhansa imunoafinitetnom kromatografijom sa spektrometrijskom detekcijom.
U radu je istražena mogućnost upotrebe brzog mikroodređenja inzulina pomoću kapilarne elektroforeze sa detekcijom laserske fluorescencije.Analiza se vrši dodavanjem uzorku poznate količine inzulina označene fenilistiotiocijanatom (FITC) i Fab fragmenta monoklonalnih inzulinskih antitijela. Označene i redovne insuline konkurentno reagiraju s kompleksom Fab. FITZ-označeni inzulin i njegov kompleks sa Fab odvajaju se za 30 sekundi.
Genetski inzulin

Pitanje od čega se proizvodi inzulin ne zanima samo liječnike i farmaceute, već i bolesnike sa šećernom bolešću, kao i njihove rodbine i prijatelje.
Danas se ovaj jedinstveni i tako važan hormon za zdravlje ljudi može nabaviti iz različitih sirovina pomoću posebno razvijenih i pažljivo testiranih tehnologija. Ovisno o načinu pripreme, razlikuju se sljedeće vrste inzulina:
- Svinjetina ili govedina, koji se nazivaju i životinjskim proizvodom
- Modificirana biosintetska svinja
- Genetski inženjer ili rekombinant
- Genetski modifikovana
- Sintetički
Svinjski inzulin se najduže koristi kod dijabetesa. Primjena je započeta još u 20-ima prošlog stoljeća.
Treba napomenuti da je svinjetina ili životinja bila jedini lijek do 80-ih godina prošlog stoljeća. Da bi se postiglo koristi se životinjsko tkivo gušterače.
Međutim, ovu metodu teško je nazvati optimalnom ili jednostavnom: rad s biološkim sirovinama nije uvijek prikladan, a ni sama sirovina nije dovoljna.
Uz to, sastav svinjskog inzulina ne podudara se potpuno sa sastavom hormona koji proizvodi zdrava osoba: u njihovoj strukturi su prisutni razni aminokiselinski ostaci. Treba napomenuti da hormoni koje proizvodi gušterača goveda imaju još veći broj razlika, što se ne može nazvati pozitivnom pojavom.
U takvom pripravku, osim čiste višekomponentne tvari, uvijek se sadrži takozvani proinsulin, tvar koja se ne može odvojiti suvremenim metodama čišćenja. Upravo on često postaje izvor alergijskih reakcija, što je posebno opasno za djecu i starije osobe.
Ljekarne još jednom žele unovčiti dijabetičare. Razuman je moderni europski lijek, ali o tome šute. Ovo je.
Zbog toga su naučnici širom svijeta već dugo zainteresirani da se sastav hormona koji proizvode životinje potpuno uskladi sa hormonima pankreasa zdrave osobe. Pravi proboj u farmakologiji i liječenju dijabetesa bila je proizvodnja polu-sintetičkog lijeka dobivenog zamjenom aminokiseline alanin u životinjskom pripravku s treoninom.
Istovremeno, polusintetička metoda za proizvodnju hormona temelji se na upotrebi životinjskih pripravaka. Drugim riječima, oni jednostavno prolaze modifikacije i postaju identični hormonima koje proizvodi čovjek. Među njihovim prednostima je kompatibilnost s ljudskim tijelom i odsutnost alergijskih reakcija.
Nedostaci ove metode uključuju nedostatak sirovina i poteškoće u radu s biološkim materijalima, kao i visoku cijenu kako same tehnologije, tako i dobivenih lijekova.
U tom pogledu, najbolji lijek za liječenje dijabetesa je rekombinantni inzulin dobiven genetskim inženjeringom.
Uzgred, često se naziva i genetski inzulin inzulina, na taj način naznačuje način njegovog dobivanja, a dobiveni proizvod naziva se humani inzulin, čime se naglašava njegov apsolutni identitet hormonima koje proizvodi gušterača zdrave osobe.
Među prednostima inzulina genetskog inženjerstva valja napomenuti i njegov visoki stupanj čistoće i nedostatak proinzulina, kao i činjenicu da ne izaziva nikakve alergijske reakcije i nema kontraindikacije.
Često postavljeno pitanje je razumljivo: od čega se točno pravi rekombinantni inzulin? Ispada da ovaj hormon proizvodi sojevi kvasca, kao i Escherichia coli koji su smješteni u poseban hranjivi medij. Štoviše, količina dobivene tvari toliko je velika da je moguće potpuno odustati od upotrebe lijekova dobivenih iz životinjskih organa.
Naravno, ne radi se o jednostavnoj E. coli, već o gensko modificiranom i sposobnom da proizvodi topljivi ljudski genetski inzulinski inzulin, čiji su sastav i svojstva potpuno isti kao i hormon koji stvaraju stanice gušterače zdrave osobe.
Prednosti inzulina genetskog inženjerstva nisu samo njegova apsolutna sličnost ljudskom hormonu, već i jednostavnost pripreme, dovoljna količina sirovina i pristupačna cijena.
Naučnici širom svijeta proizvodnju rekombinantnog inzulina nazivaju pravim otkrićem u liječenju dijabetesa. Značaj ovog otkrića je toliko velik i važan da ga je teško precijeniti.
Dovoljno je jednostavno napomenuti da se danas gotovo 95% potreba za ovim hormonom zadovoljava uz pomoć genetski inženjera inzulina.
Istovremeno, hiljade ljudi koji su ranije imali alergiju na lijekove dobili su šansu za normalan život.
Imao sam dijabetes 31 godinu. Sada je zdrav. Ali, ove su kapsule nedostupne običnim ljudima, ne žele prodavati ljekarne, za njih je to neprofitabilno.
Kako djeluje inzulin za ljudski inženjering
U liječenju šećerne bolesti tipa 1 koristi se dvofazni humani genetski inženjering inzulina. U ljekarnama se prodaje u obliku otopine i ima oznaku "Voljeno". Druga vrsta bolesti također se može liječiti takvim lijekom ako propisani lijekovi nisu prikladni za dijabetičare.
Genetski modifikovani inzulin koristi se i ako osoba ima dijabetičku komu. Liječnici često prepisuju injekcije trudnicama s dijagnozom šećerne bolesti kada tablete za snižavanje šećera i terapijska dijeta ne pomažu.
Generalno se genetski inženjerni inzulini ili GMO koriste tokom porođaja, kada se podvrgnu operaciji ili ako je dijabetičar ozbiljno povrijeđen. Lijek vam omogućuje da sigurno pređete na upotrebu hormona koji brzo djeluju.
- Prije upotrebe inzulina dvofazni humani genetski inženjering, potrebno je napraviti test i otkriti je li ovaj lijek pogodan za pacijenta. Ako kod dijabetičara bude otkrivena hipoglikemija, ne preporučuje se upotreba lijeka.
- Shema djelovanja otopine je da genetski inženjerirani inzulin stupa u interakciju sa stanicama, što dovodi do stvaranja kompleksa. Kada ćelije uđu u ove komplekse, stimulišu se i počinju aktivnije raditi. Kao rezultat toga, stvara se više enzima.
- U tom se procesu brže apsorbira glukoza, aktivno se preradjuju ugljikohidrati koji uđu u organizam. Tako, jetra duže proizvodi glukozu, a proteini se mogu brže apsorbirati.
Princip djelovanja lijeka ovisi o dozi, vrsti inzulina, izboru mjesta ubrizgavanja. Bilo koji postupak treba obaviti tek nakon dogovora s lekarom. Prve injekcije se rade pod medicinskim nadzorom.
Preporuke za upotrebu leka
Kao ili bifazni inzulinski ljudski genetski inženjering ima različita trgovačka imena. Takođe, hormoni mogu varirati u trajanju djelovanja, načinu pripreme rastvora. Proizvodi se nazivaju na osnovu vrste inzulina.
Genetski modificirani insulini dio su takvih lijekova kao što su Humudar, Vozulim, Actrapid. Insuran, Gensulin. Ovo nije potpuni popis takvih lijekova, njihov je broj prilično velik.
Svi gore navedeni lijekovi razlikuju se u pogledu izloženosti organizmu.GMO mogu trajati nekoliko sati ili biti aktivni cijeli dan.
Dvofazni kombinirani lijekovi uključuju lijekove koji uključuju određene komponente koje mijenjaju razdoblje izloženosti lijeku.
- Ovakvi lijekovi se prodaju u obliku mješavina, uključujući hormone dobivene genetski.
- Ova sredstva uključuju Mikstard, Insuman, Gansulin, Gensulin.
- Lijekovi se koriste dva puta dnevno, pola sata prije obroka. Takvog sistema treba strogo pridržavati, jer je hormon direktno povezan s vremenom unosa hrane.
Proizvodnjom ljudskog insulina dobija se preparat koji ima prosečno vreme izlaganja.
- Otopina stupa na snagu u roku od 60 minuta, ali trenutak najveće aktivnosti opaža se šest do sedam sati nakon injekcije.
- Lijek se u potpunosti uklanja iz tijela nakon 12 sati.
- Takvi lijekovi uključuju Insuran, Insuman, Protafan, Rinsulin, Biosulin.
Postoje i GMO-ovi koji imaju kratkotrajno izlaganje organizmu. Uključuju lijekove inzulin Actrapid, Gansulin, Humulin, Insuran, Rinsulin, Bioinsulin. Takvi inzulini imaju aktivnu fazu nakon dva do tri sata, a prvi znakovi lijeka mogu se uočiti već pola sata nakon injekcije.
Prije primjene inzulina, GMO se mora ispitati na postojanost i odsutnost stranih tvari u tekućini. Ako se u lijeku pojave strane tvari, zamućenost ili taloženje, bočica se mora odbaciti - lijek nije prikladan za upotrebu.
Upotrebljeni inzulin mora biti na sobnoj temperaturi. Doziranje hormona mora se prilagoditi ako dijabetičar ima zaraznu bolest, disfunkciju štitnjače, Addisonovu bolest, hipopituitarizam i hroničnu bolest bubrega.
Napadi hipoglikemije mogući su kod prekomjerne doze lijeka, u slučaju prelaska na novu vrstu inzulina zbog preskakanja obroka ili fizičkog prekomjernog opterećenja. Takođe, krivnja mogu biti bolesti koje smanjuju potrebu za hormonom - težak stepen bubrežnih bolesti, bolesti jetre, smanjena štitna žlijezda, nadbubrežna kora i hipofiza.
- Nagli pad šećera u krvi moguć je uz promjenu područja ubrizgavanja. Stoga je neophodno razumno prelaziti s jedne vrste inzulina i to tek nakon dogovora s liječnikom.
- Ako dijabetičar koristi inzulin kratkog djelovanja, ponekad se volumen masnog tkiva smanjuje na mjestu ubrizgavanja ili, obrnuto, povećava. Da bi se to sprečilo injekcija se mora učiniti na različitim mestima.
Trudnice moraju biti svjesne da potrebe za insulinom mogu biti različite u različitim tromjesečjima trudnoće. Da biste to učinili, morate provesti svakodnevni test šećera u krvi s glukometrom.
Djelovanje inzulina na ljudsko tijelo detaljno je opisano u videu u ovom članku.
1. Struktura i funkcije inzulina 5
1.1. Struktura molekula insulina 5
1.2. Biološki značaj inzulina 7
1.3. Biosinteza inzulina 8
2. Sinteza inzulina genetskog inženjeringa 10
2.1. Primjena metoda genetskog inženjeringa za sintezu lijekova 10
2.2. Metode genetskog inženjeringa 11
2.3. Proizvodnja inzulina genetskog inženjeringa 14

Zaključak 18
Simptomi predoziranja
Pri korištenju inzulina važno je pridržavati se preporuka liječnika i pridržavati se točne doze propisanog lijeka.
U slučaju nepoštivanja pravila i predoziranja, dijabetičar počinje imati jake glavobolje, grčeve, glad, znojenje, otkucaje srca, osoba postaje preopterećena, iritirana. Mogu se primijetiti i hladnoća u cijelom tijelu i drhtanje.
Takvi su simptomi vrlo slični znakovima smanjenja glukoze u krvi.Uz blagu fazu simptoma, dijabetičar može samostalno riješiti problem i poboljšati stanje. Da biste to postigli, jedite slatkiše ili bilo koji drugi slatki proizvod koji sadrži šećer.
- Ako dođe do dijabetičke kome, koriste otopinu dekstroze, lijek se primjenjuje intravenski, dok osoba nije pri svijesti. Na prve sumnjive znakove potrebno je pozvati hitnu pomoć, koja će hitnim metodama moći oživjeti pacijenta.
- Kao nuspojave nakon upotrebe GMO-a, osoba ima osip na koži u obliku urtikarije, dijelovi tijela nabubre, krvni tlak naglo pada, može se pojaviti svrab i kratkoća daha. Ovo je alergijska reakcija na lijek, koja nakon nekog vremena može nestati sama bez medicinske intervencije. Ako se situacija nastavi, trebali biste se posavjetovati sa ljekarom.
- U ranim danima uzimanja pripravka inzulina kod dijabetičara, tijelo je često dehidrirano, osoba pati od nedostatka tekućine, apetit se pogoršava, pojavljuju se otekline na rukama i nogama i osjeća se stalna pospanost. Takvi simptomi obično brzo nestaju i ne ponavljaju se.
Recenzije i komentari
Imam dijabetes tipa 2 - ne zavisi od insulina. Jedna prijateljica savjetovala je sniženje šećera u krvi pomoću DiabeNot-a. Poručio sam putem interneta. Započeo je prijem.
Slijedim nestrogu dijetu, svako jutro sam počeo pješke 2-3 kilometra. U protekle dvije sedmice primjećujem neznatan pad šećera na brojilu ujutro prije doručka sa 9,3 na 7,1, a juče čak na 6.
1! Nastavljam preventivni kurs. Odjavit ću se za uspjehe.
Margarita Pavlovna, sad sjedim i na Diabenotu. SD 2. Zaista nemam vremena za dijetu i šetnje, ali ne zloupotrebljavam slatkiše i ugljene hidrate, mislim da XE, ali zbog starosti šećer je i dalje visok.
Rezultati nisu tako dobri kao vaši, ali za 7,0 šećera ne izlazi tjedan dana. S kojim glukometrom mjerite šećer? Pokazuje li vam plazmu ili punu krv? Želim da uporedim rezultate uzimanja lijeka.
Hvala vam puno na takvom informativnom postu.
Proizvodnja inzulina genetskog inženjerstva

Da biste se osoba osjećala zdravo, morate pratiti nivo inzulina u tijelu. Ovaj hormon bi trebao biti dovoljan da se glukoza ne akumulira u krvi. Inače, u slučaju metaboličkih poremećaja, liječnik dijagnosticira dijabetes.
Terapija za napredni stadijum šećerne bolesti je da nadoknadi nedostajuću koncentraciju inzulina koju tijelo ne može prirodno proizvesti. Za to se koristi topljivi inzulin koji je sličan ljudskom genetičkom inženjerstvu. Gušterača je odgovorna za proizvodnju takvog hormona.
Za proizvodnju inzulina ne koristi se samo tehnologija proizvodnje prirodnog hormona, proizvođači koriste i umjetno dobiveni modificirani inzulin. Lijek s oznakom "solubilis" naznačen je kao topljiv.
Vrste lijekova
Kao ili bifazni inzulinski ljudski genetski inženjering ima različita trgovačka imena. Takođe, hormoni mogu varirati u trajanju djelovanja, načinu pripreme rastvora. Proizvodi se nazivaju na osnovu vrste inzulina.
Genetski modificirani insulini dio su takvih lijekova kao što su Humudar, Vozulim, Actrapid. Insuran, Gensulin. Ovo nije potpuni popis takvih lijekova, njihov je broj prilično velik.
Svi gore navedeni lijekovi razlikuju se u pogledu izloženosti organizmu. GMO mogu trajati nekoliko sati ili biti aktivni cijeli dan.
Dvofazni kombinirani lijekovi uključuju lijekove koji uključuju određene komponente koje mijenjaju razdoblje izloženosti lijeku.
- Ovakvi lijekovi se prodaju u obliku mješavina, uključujući hormone dobivene genetski.
- Ova sredstva uključuju Mikstard, Insuman, Gansulin, Gensulin.
- Lijekovi se koriste dva puta dnevno, pola sata prije obroka. Takvog sistema treba strogo pridržavati, jer je hormon direktno povezan s vremenom unosa hrane.
Proizvodnjom ljudskog insulina dobija se preparat koji ima prosečno vreme izlaganja.
- Otopina stupa na snagu u roku od 60 minuta, ali trenutak najveće aktivnosti opaža se šest do sedam sati nakon injekcije.
- Lijek se u potpunosti uklanja iz tijela nakon 12 sati.
- Takvi lijekovi uključuju Insuran, Insuman, Protafan, Rinsulin, Biosulin.
Postoje i GMO-ovi koji imaju kratkotrajno izlaganje organizmu. Uključuju lijekove inzulin Actrapid, Gansulin, Humulin, Insuran, Rinsulin, Bioinsulin. Takvi inzulini imaju aktivnu fazu nakon dva do tri sata, a prvi znakovi lijeka mogu se uočiti već pola sata nakon injekcije.
Takvi lijekovi se u potpunosti izlučuju nakon šest sati.
Upotreba humano topivog inzulina humano genetski zasnovanog za dijabetes

Ljudski genetski inzulinski inzulin uobičajena je zamjena hormona za inzulin koji stvara gušterača. Za sintezu se koristi ne samo genetski modificirani ljudski hormon, nego i sintetski stvorena tvar. Druga poznata opcija za stvaranje leka je upotreba modifikovanog inzulina za svinje, jer po svom sastavu i funkcijama najbliži je čovjeku. Raspored proizvodnje inzulina za genetski inženjering. Genetski modificirani inzulin može se koristiti i za dijabetes melitus tipa 1 i za dijabetes tipa 2, kada se primijeti stalna reakcija na oralne lijekove s hipoglikemijskom prirodom. Može se koristiti kada je pacijent u određenim vrstama kome. Ako je trudnica tek počela dobivati dijabetes, tada je dozvoljena primjena inženjerskog inzulina, ali samo ako prehrana ne pomaže utjecati na razinu glukoze. Njegova se upotreba preporučuje u slučajevima infekcije infekcijama kod kojih se može primijetiti hipertermija. Genski preparati uspješni su u njihovoj primjeni tijekom porođaja, operacija, ozljeda, metaboličkih poremećaja i u slučaju postupnog prelaska na inzulin s dugim djelovanjem. Zabranjeno je koristiti genske pripravke koji zamjenjuju hormon s preosjetljivošću na određene elemente lijeka i s hipoglikemijom. Lijekovi ove vrste reagiraju s određenim receptorima staničnih membrana, tvoreći s njima komplekse. Kada uđe u ćelije, kompleks leka utiče na rad, podstičući ga da bude aktivniji i da proizvodi dodatne enzime. Razina glukoze opada zbog činjenice da je ćelije brže prerađuju. Nakon toga ubrzava se proces lipogeneze, proizvodnja proteina i smanjuje se brzina jetre u stvaranju glukoze. Trajanje lijeka ovisit će o mjestu ubrizgavanja, vrsti lijeka, dozi i pojedinačnom odgovoru ljudskog tijela. Samo liječnik može postaviti doze i propisati određene lijekove u ovoj grupi. U početnom razdoblju uzimanja lijekova pacijenti pažljivo nadziru pacijenta kako bi otkrili je li lijek odbačen. Ljudski genetski modificirani inzulin sadržan je u tako poznatim lijekovima kao što su Insuran, Insuman, Vozulim, Penfill, Biosulin, Gensulin, Actrapid, Rinsulin, Humulin, Humudar, Rosinsulin i neki drugi. Postoje različite vrste inzulina.Jedna od klasifikacija odnosi se na trajanje lijeka. Prema njenim riječima, rastvorljivi inzulin može imati kratko i dugo djelovanje. Postoje kombinovani lekovi (dvofazni insulin), koji sadrže supstancu brzog i dugotrajnog delovanja. Ova vrsta lijekova naziva se mješavina. Među njima je i onih koji se stvaraju s promjenom ljudskog hormona. Dvofazni inzulin su Mikstard, Gansulin, Insuman, Humulin i Gensulin. Treba ih koristiti dva puta dnevno, pola sata prije jela. To je zbog činjenice da dvofazni inzulin ima supstancu kratkog djelovanja, čiji unos ovisi o prehrani. Inženjerski analog ljudskog hormona je među lijekovima sa prosječnim stepenom trajanja. Ovaj rastvorljivi inzulin počinje djelovati nakon sat vremena, a vrhunac svoje aktivnosti događa se nakon 7 sati. Nakon 12 sati prikazuje se. Ljudski genetski modificirani lijek ove skupine su Insuman, Protafan, Humulin, Rinsulin, Biosulin, Gensulin, Gansulin, Insuran. Među grupom postoji kratko genetski proizveden lijek koji ima kratku akciju. Na primjer, to uključuju Gansulin, Insuran, Humulin, Rinsulin, Gensulin, Bioinsulin i Actrapid. Takav rastvorljivi inzulin počinje djelovati za pola sata, a njegova aktivnost doseže svoj maksimalan nivo za par sati. Takvi se lijekovi izlučuju 6 sati. U slučaju predoziranja lijekovima s genetski modificiranim inzulinom može doći do slabosti, pospanosti, umora, razdražljivosti, zimice, pojačanog izlučivanja hladnog znoja, drhtavice, blijedosti, palpitacija, glavobolje, grčeva i gladi. Sve su to simptomi hipoglikemije. Ako se ova bolest tek počela razvijati i nalazi se u svojim ranijim, lakšim stadijima, tada sve simptome možete ukloniti sami. Da biste to učinili, morate jesti hranu sa šećerom i s mnogo ugljikohidrata, koja se lako probavlja. Rastvor glukagona i dekstroze može se uvesti u organizam. Ako je osoba pala u komu, tada morate ubrizgati modificirano rješenje dekstroze dok se situacija ne poboljša. Neki ljudi mogu razviti alergijske reakcije na upotrebu genetski modificiranih lijekova s inzulinom. Simptomi mogu biti osip, oteklina, slabost, nizak krvni pritisak, kratkoća daha, osip, groznica i svrbež. U nekim slučajevima se javljaju hipoglikemija i koma. Mogu se javiti problemi sa ljudskom sviješću, pa čak i koma. Ako je pacijent propustio lijekove, tada može razviti hiperglikemiju. Pojavljuje se zbog preliminarnih malih doza, s razvojem zaraznih pojava u tijelu, ali i ako se ne pridržavate pravila prehrane. U nekim slučajevima pacijent može razviti lipodistrofiju na mjestima gdje se daje lijek. Na početku upotrebe lijeka može se pojaviti nadutost, nedostatak vode, pospanost i pokvarenost apetita. Ali ove pojave su privremene. Upotreba nadomjestka prirodnom inzulinu, poput genetski inženjerske tvari, izvrstan je dodatak za liječenje dijabetesa. Pomaže u smanjenju razine šećera zbog činjenice da ćelije glukozu više apsorbiraju, a procesi njegovog transporta se mijenjaju. Ali ove lekove treba upotrebljavati strogo prema receptu lekara, jer mogu prouzrokovati neželjene zdravstvene efekte za pacijenta. Inzulin je glavni lijek za liječenje dijabetesa tipa 1. Ponekad se koristi i za stabilizaciju pacijenta i poboljšanje njegove dobrobiti kod druge vrste bolesti. Ova supstanca po svojoj prirodi je hormon koji je sposoban utjecati na metabolizam ugljikohidrata u malim dozama. Pankreas normalno proizvodi dovoljno inzulina koji pomaže u održavanju fiziološke razine šećera u krvi. Ali s ozbiljnim endokrinim poremećajima, jedina šansa za pomoć pacijentu često su injekcije inzulina. Nažalost, nemoguće ga je uzimati oralno (u obliku tableta), jer se on potpuno uništava u probavnom traktu i gubi svoju biološku vrijednost. Dobivanje ovog hormona iz gušterače svinja i goveda stara je tehnologija koja se danas rijetko koristi. To je zbog niskog kvaliteta primljenog lijeka, njegove sklonosti izazivanju alergijskih reakcija i nedovoljnog stepena pročišćavanja. Činjenica je da se, pošto je hormon proteinska supstanca, sastoji od određenog niza aminokiselina. Insulin proizveden u organizmu svinje razlikuje se u sastavu aminokiselina od humanog inzulina za 1 aminokiselinu, a goveđeg insulina za 3. Početkom i sredinom 20. stoljeća, kada slični lijekovi nisu postojali, čak je i takav inzulin bio proboj u medicini i omogućio je liječenje dijabetičara na novi nivo. Hormoni dobiveni ovom metodom smanjili su šećer u krvi, međutim oni su često izazivali nuspojave i alergije. Razlike u sastavu aminokiselina i nečistoća u lijeku utjecale su na stanje pacijenata, posebno kod ranjivijih kategorija bolesnika (djece i starijih osoba). Još jedan razlog loše tolerancije takvog inzulina je prisustvo njegovog neaktivnog prekursora u lijeku (proinsulin), kojeg se nije bilo moguće riješiti u ovoj varijaciji lijeka. Danas postoje napredni svinjski inzulini koji su lišeni tih nedostataka. Dobivaju se iz gušterače svinje, ali nakon toga podvrgavaju se dodatnoj obradi i pročišćavanju. Višekomponentne su i sadrže pomoćne tvari. Modificirani svinjski inzulin praktično se ne razlikuje od ljudskog hormona, tako da se još uvijek koristi u praksi Takve lijekove pacijenti tolerišu puno bolje i praktički ne uzrokuju neželjene reakcije, ne inhibiraju imunološki sustav i efikasno smanjuju šećer u krvi. Goveđi inzulin danas se ne koristi u medicini, jer zbog svoje strane strukture negativno utječe na imuni i ostale sisteme ljudskog tijela. Ljudski inzulin, koji se koristi za dijabetičare, u industrijskoj se mjeri dobiva na dva načina: Uslovi skladištenja inzulinaIndikacije i kontraindikacije
Farmakološko djelovanje lijekova
Primjeri genetski proizvedenih humanih inzulinskih lijekova
Od čega se proizvodi insulin?

Pripravci dobiveni od sirovina životinjskog porijekla
Genetski inzulin inzulin
S fizikalno-hemijskom promjenom, molekuli svinjskog inzulina pod djelovanjem posebnih enzima postaju identični ljudskom inzulinu. Aminokiselinski sastav rezultirajućeg pripravka ne razlikuje se od sastava prirodnog hormona koji se proizvodi u ljudskom tijelu.
Tijekom procesa proizvodnje lijek se podvrgava visokom pročišćavanju, stoga ne izaziva alergijske reakcije ili druge nepoželjne manifestacije.
Ali najčešće se inzulin dobija pomoću modificiranih (genetski modificiranih) mikroorganizama. Korištenjem biotehnoloških metoda, bakterije ili kvasci modificiraju se na takav način da sami mogu proizvesti inzulin.
Pored same proizvodnje inzulina, njegovo pročišćavanje igra važnu ulogu. Kako lijek ne izaziva nikakve alergijske i upalne reakcije, u svakoj fazi potrebno je pratiti čistoću sojeva mikroorganizama i svih otopina, kao i korištenih sastojaka.
Postoje dvije metode za takvu proizvodnju inzulina. Prvi od njih temelji se na korištenju dva različita soja (vrste) jednog mikroorganizma.
Svaki od njih sintetizira samo jedan lanac molekule hormona DNA (postoje ih samo dva, a spiralno su upleteni zajedno).
Tada se ovi lanci povezuju, a u rezultirajućem rješenju je već moguće odvojiti aktivne oblike inzulina od onih koji nemaju biološki značaj.
Drugi način dobivanja lijeka pomoću Escherichia coli ili kvasca temelji se na činjenici da mikrob prvo proizvodi neaktivni inzulin (to jest njegov prethodnik, proinsulin). Tada se pomoću enzimskog liječenja ovaj oblik aktivira i koristi u medicini.
Osoblje koje ima pristup određenim proizvodnim pogonima uvijek treba biti obučeno u sterilno zaštitno odijelo kojim se eliminira kontakt lijeka s ljudskim biološkim tekućinama.
Svi su ti procesi automatski automatizirani, zrak i sve površine u kontaktu s ampulama i bočicama su sterilne, a linije s opremom hermetički su zatvorene.
Biotehnološke metode omogućavaju naučnicima da razmišljaju o alternativnim rješenjima za dijabetes.
Na primjer, do danas se provode predklinička ispitivanja proizvodnje umjetnih beta ćelija gušterače, koja se mogu dobiti metodama genetskog inženjeringa.
Možda će ih u budućnosti koristiti za poboljšanje funkcionisanja ovog organa kod bolesne osobe.
Proizvodnja savremenih inzulinskih pripravaka je složen tehnološki proces koji uključuje automatizaciju i minimalnu ljudsku intervenciju
Dodatne komponente
Proizvodnja inzulina bez pomoćnih sastojaka u modernom svijetu gotovo je nemoguće zamisliti, jer oni mogu poboljšati njegova kemijska svojstva, produžiti vrijeme djelovanja i postići visoki stupanj čistoće.
Svi dodatni sastojci se prema svojim svojstvima mogu podijeliti u sljedeće klase:
- sredstva za produženje (tvari koje se koriste da osiguraju duže trajanje djelovanja lijeka),
- komponente za dezinfekciju
- stabilizatori, zbog kojih se u otopini lijeka održava optimalna kiselost.
Dodaci za produženje
Postoje inzulini dugog djelovanja čija biološka aktivnost traje 8 do 42 sata (ovisno o skupini lijeka). Taj se učinak postiže dodatkom posebnih tvari - produživača otopini za ubrizgavanje. U ovu svrhu se najčešće koristi jedno od sledećih jedinjenja:
Proteini koji produžuju djelovanje lijeka podvrgavaju se detaljnom pročišćavanju i nisko su alergeni (na primjer, protamin). Cink soli takođe ne utiču negativno na aktivnost inzulina niti na dobrobit ljudi.
Dezinficijensi u sastavu inzulina su potrebni kako se mikrobna flora ne razmnožava tokom skladištenja i upotrebe u njoj. Ove tvari su konzervansi i osiguravaju očuvanje biološke aktivnosti lijeka.
Uz to, ako pacijent primjenjuje hormon iz jedne bočice samo u sebe, lijek može trajati nekoliko dana.
Zbog visokokvalitetnih antibakterijskih komponenti neće imati potrebu bacati neiskorišteni lijek zbog teorijske mogućnosti reprodukcije u otopini mikroba.
Sledeće tvari se mogu koristiti kao dezinficijensi u proizvodnji inzulina:
Ako otopina sadrži cinkove ione, oni djeluju i kao dodatni konzervans zbog svojih antimikrobnih svojstava
Za proizvodnju svake vrste inzulina pogodne su određene komponente za dezinfekciju. Njihova interakcija s hormonom mora se istražiti u fazi predkliničkih ispitivanja, jer konzervans ne smije poremetiti biološku aktivnost inzulina ili na drugi način negativno utjecati na njegova svojstva.
Upotreba konzervansa u većini slučajeva omogućava davanje hormona ispod kože bez prethodnog tretmana alkoholom ili drugim antisepticima (proizvođač to obično navodi u uputama).
To pojednostavljuje primjenu lijeka i smanjuje broj pripremnih manipulacija prije same injekcije.
Ali ova preporuka djeluje samo ako se otopina primjenjuje pomoću pojedinačne inzulinske šprice s tankom iglom.
Stabilizatori
Stabilizatori su potrebni tako da se pH rastvora održava na zadanom nivou. Očuvanje lijeka, njegovo djelovanje i stabilnost hemijskih svojstava ovise o razini kiselosti. U proizvodnji hormona ubrizgavanja za pacijente s dijabetesom u ovu se svrhu obično koriste fosfati.
Za inzulin sa cinkom nisu uvijek potrebni stabilizatori rastvora, jer ioni metala pomažu u održavanju potrebne ravnoteže.
Ako se ipak koriste, tada se umjesto fosfata koriste drugi kemijski spojevi, jer kombinacija tih tvari dovodi do taloženja i nepodobnosti lijeka.
Važno svojstvo koje je pokazano svim stabilizatorima je sigurnost i nemogućnost ulaska u bilo kakve reakcije na inzulin.
Nadležni endokrinolog treba se baviti odabirom lijekova za ubrizgavanje dijabetesa za svakog pojedinog pacijenta.
Zadatak inzulina nije samo da održava normalnu razinu šećera u krvi, već i da ne nanosi štetu drugim organima i sistemima. Lijek treba biti hemijski neutralan, slabo alergen i po mogućnosti dostupan.
Također je prikladno ako se odabrani inzulin može miješati sa ostalim njegovim verzijama prema trajanju djelovanja.
Dobivanje inzulina, metode genetskog inženjerstva, biotehnologija - kursevi

1. Struktura i funkcije inzulina 5
1.1. Struktura molekula insulina 5
1.2. Biološki značaj inzulina 7
1.3. Biosinteza inzulina 8
2. Sinteza inzulina genetskog inženjeringa 10
2.1. Primjena metoda genetskog inženjeringa za sintezu lijekova 10
2.2. Metode genetskog inženjeringa 11
2.3. Proizvodnja inzulina genetskog inženjeringa 14