Biosinteza holesterola i njegova biohemija - Dijabetes
Bez sumnje, holesterol je najpoznatiji lipidi u široj javnosti, on je poznat po visokoj povezanosti visokog kolesterola u krvi i učestalosti kardiovaskularnih bolesti kod ljudi. Manje pozornosti posvećeno je presudnoj ulozi kolesterola kao komponente ćelijskih membrana i kao prethodnika steroidnih hormona i žučnih kiselina. Holesterol je potreban mnogim životinjama, pa tako i ljudima, ali njegova prisutnost u hrani sisara nije obvezna - tjelesne stanice same ga mogu sintetizirati iz jednostavnih prekursora.
Struktura ovog jedinjenja sa 27 ugljika sugerira složen put njegove biosinteze, ali sve njegove ugljikove atome osigurava jedan prekursor - acetat. Izoprenski blokovi - najvažniji međuprodukti od acetata do kolesterola, oni su prekursori mnogih prirodnih lipida, a mehanizmi pomoću kojih se izoprenski blokovi polimeriziraju slični su u svim metaboličkim putevima.
Započinjemo ispitivanjem glavnih faza na putu biosinteze holesterola iz acetata, zatim razgovaramo o transportu holesterola kroz krvotok, njegovoj apsorpciji ćelijama, normalnoj regulaciji sinteze kolesterola i regulaciji poremećene apsorpcije ili transporta. Zatim pogledamo ostale supstance koje potiču iz holesterola, poput žučnih kiselina i steroidnih hormona. Konačno, opis biosintetskih puteva za formiranje mnogih spojeva - derivata izoprenskih blokova u kojima postoje uobičajene rane faze sa sintezom holesterola, ilustrirat će izvanrednu svestranost izoprenoidne kondenzacije u biosintezi.
Holesterol se proizvodi iz acetil-CoA u četiri stupnja
Holesterol, poput masnih kiselina dugog lanca, proizvodi se od acetil-CoA, ali obrazac montaže je potpuno drugačiji. U prvim eksperimentima u hranu za životinje dodan je acetat označen sa 14 ° C na atomu metila ili karboksil ugljika. Na temelju raspodjele oznake u kolesterolu izdvojenom iz dvije grupe životinja (Sl. 21-32) opisani su enzimski stadiji biosinteze holesterola.
Sl. 21-32. Izvor ugljikovih atoma holesterola. Identificirano tokom eksperimenata pomoću radioaktivnog acetata označenog metil ugljikom (crnim) ili karboksilnim ugljikom (crveno). U kondenziranoj strukturi prstenovi su označeni slovima od A do D.

Sinteza se odvija u četiri stupnja, kao što je prikazano na Sl. 21-33: (1) kondenzacija tri acetatna ostatka da bi se formirao intermedijat sa šest ugljika mevalonata, (2) pretvaranje mevalonata u aktivirane blokove izoprena, (3) polimerizacija šest petoro-ugljeničnih izoprenskih jedinica kako bi se formirao linearni skvalen od 30 ugljenika, (4) ciklizacija skvalena da se dobije četiri prstena jezgre steroida, nakon čega slijedi niz promjena (oksidacija, uklanjanje ili migracija metilnih skupina) sa stvaranjem holesterola.
Sl. 21-33. Generalizovana slika biosinteze holesterola. U tekstu su obrađene četiri faze sinteze. Izoprenski blokovi u skvalenu označeni su crvenim isprekidanim linijama.

Stadij (1). Sinteza mevalonata iz acetata. Prva faza biosinteze holesterola dovodi do stvaranja međuprodukta mevalonat (Sl. 21-34). Dve molekule acetil CoA kondenzuju se dajući acetoacetil CoA, koji se kondenzuje sa trećim molekulom acetil CoA i formira šest-ugljenični spoj β-hidroksi-β-metilglutaril-CoA (HM G -CoA). Te dvije prve reakcije su katalizirane tiolaze i NM G -CoA sintaza, respektivno. Citosolna NM G-CoA sintaza Ovaj metabolički put razlikuje se od mitohondrijskog izoenzima koji katalizira sintezu NM G -CoA tokom stvaranja ketonskih tijela (vidi Sl. 17-18).
Sl. 21-34. Stvaranje mevalonata iz acetil-CoA. Izvor C-1 i C-2 mevalonata iz acetil-CoA označen je ružičastom bojom.

Treća reakcija ograničava brzinu cijelog postupka. U njemu se NM G -CoA redukuje do mevalonata, za koji svaki od dva NA D PH molekula osigurava dva elektrona. HMG-CoA reduktaza - integralni membranski protein glatkog ER, služi, kao što ćemo vidjeti kasnije, kao glavna tačka regulacije metaboličkog puta stvaranja holesterola.
Faza (2). Pretvorba mevalonata u dva aktivirana izoprena. U sljedećoj fazi sinteze kolesterola, tri fosfatne skupine se prenose iz molekula ATP u mevalonat (Sl. 21-35). Fosfat vezan na hidroksilnu skupinu C-3 mevalonata u intermedijarnoj 3-fosfo-5-pirofosfomevalonatu je dobra odlazeća grupa, u sljedećem koraku oba ova fosfata i susjednu karboksilnu skupinu napuštaju, tvoreći dvostruku vezu u proizvodu s pet ugljenika ∆ 3 -izopentenil pirofosfat. Ovo je prvi od dva aktivirana izoprena - glavni učesnici u sintezi holesterola. Izomerizacija Δ3-izopentenilpirofosfata daje drugi aktivirani izopren dimetilalil pirofosfat. Sinteza izopentenil pirofosfata u citoplazmi biljnih ćelija odvija se prema opisanom putu. Međutim, biljni kloroplasti i mnoge bakterije koriste put neovisan od mevalonata. Ova alternativna ruta ne postoji kod životinja, pa je atraktivna prilikom stvaranja novih antibiotika.
Sl. 21-35. Konverzija mevalonata u aktivirane blokove izoprena. Šest aktiviranih jedinica kombinira se u obliku skvalena (vidi sliku 21-36). Odlazeće grupe 3-fosfo-5-pirofosfomevalonata označene su ružičastom bojom. U uglatim zagradama je hipotetički intermedijar.

Stadij (3). Kondenzacija šest aktiviranih izoprenskih jedinica u oblik skvalena. Izopentenil pirofosfat i dimetilalil pirofosfat sada se podvrgavaju kondenzaciji od glave do repa u kojoj se kreće jedna pirofosfatna grupa i formira se lanac od 10 ugljenika - geranil pirofosfat (Sl. 21-36). (Pirofosfat se pridaje na glavi.) Geranil pirofosfat podvrgava se slijedećoj kondenzaciji od glave do repa sa izopentenil pirofosfatom i 15 ugljikovim međuproduktima farnezil pirofosfat. Konačno, dve molekule farnezil pirofosfata kombinuju se "od glave do glave", obe fosfatne grupe se uklanjaju - formiraju se skvalen.
Sl. 21-36. Formiranje skvalena. Squalene struktura koja sadrži 30 atoma ugljika nastaje tijekom uzastopnih kondenzacija aktiviranih izoprenskim (pet-ugljikovim) blokovima.

Uobičajeni nazivi za ove intermedijare potječu od imena izvora iz kojih su prvi izolirani. Geraniol, sastojak ružinog ulja, ima aromu geranije, a farnesol, koji se nalazi u bojama bagremove farnese, ima aromu ljiljana. Mnogi prirodni biljni mirisi pripadaju spojevima izgrađenim od izoprenskih blokova. Skvalen, prvi izoliran iz jetre morskog psa (vrsta Squalus), sastoji se od 30 atoma ugljika: 24 atoma u glavnom lancu i šest atoma u metalnim supstituentima.
Faza (4). Transformacija skvalena u četiri prstena steroidnog jezgra. U fig. 21-37 jasno se vidi kako struktura lanca skvalena, a steroli - ciklični. Svi steroli imaju četiri kondenzirana prstena koji tvore jezgro steroida, a svi su alkoholi s hidroksilnom skupinom na C-3 atomu, otuda i engleski naziv sterol. Pod akcijom skvalen monooksigenaza na kraju lanca skvalena dodaje se jedan atom kisika iz O 2 i nastaje epoksid. Ovaj enzim je druga oksidaza mješovite funkcije (dodavanje 21-1), NADPH smanjuje još jedan atom kisika iz O 2 do H2 O. Proizvod Dvostruke kravate skvalen-2,3-epoksid raspoređeni tako da izuzetno dosljedna reakcija može pretvoriti lanac skvalen epoksida u cikličku strukturu. U životinjskim ćelijama ova ciklizacija dovodi do stvaranja lanosterol koji sadrži četiri prstena karakteristična za steroidno jezgro. Kao rezultat toga, lanosterol se pretvara u holesterol kroz niz od oko 20 reakcija, što uključuje migraciju nekih metalnih grupa i uklanjanje drugih. Opis ovog čudesnog puta biosinteze, jednog od najtežih među poznatim, napravili su Conrad Bloch, Theodore Linen, John Cornfort i George Popiak krajem 1950-ih.
Sl. 21-37. Zatvaranje prstena pretvara linearni skvalen u kondenzovanu steroidnu jezgru. Prvi stupanj katalizira oksidaza sa mješovitom funkcijom (monooksigenaza), čija je kosubstrata N AD PH. Proizvod je epoksid, koji u sljedećoj fazi ciklizira i tvori steroidnu jezgru. Konačni produkt tih reakcija u životinjskim ćelijama je holesterol, a kod ostalih se organizama formiraju steroli malo drugačiji od njega.


Holesterol je sterol karakterističan za životinjske stanice, biljke, gljivice i protisti daju druge vrlo slične sterole.
Koriste isti put sinteze da skvalen-2,3-epoksid, ali se putevi malo razilaze i stvaraju se drugi steroli, poput sigmasterola u mnogim biljkama i ergosterola u gljivama (sl. 21-37).
Primer 21-1 Troškovi energije za sintezu skvalena
Koliki su troškovi energije (izraženi kao ATP molekuli) za sintezu jedne molekule skvalena?
Rješenje. U sintezi skvalena iz acetil-CoA ATP se troši samo u fazi kada se mevalonat pretvara u aktivirani prekursor izoprena skvalena. Za izgradnju molekule skvalena potrebno je šest aktiviranih molekula izoprena, a tri molekula ATP potrebna su za proizvodnju svake aktivirane molekule. Ukupno, 18 molekula ATP-a troši se na sintezu jedne molekule skvalena.
Jedinjenja holesterola u tijelu
Kod kičmenjaka se u jetri sintetišu velike količine holesterola. Dio kolesterola koji je tamo sintetizovan ugrađen je u membrane hepatocita, ali on se uglavnom izvozi u jednom od tri svoja oblika: bilijarnom (žučnom) kolesterolu, žučnim kiselinama ili esterima holesterola. Žučne kiseline a njihove soli su hidrofilni derivati holesterola, koji se sintetiziraju u jetri i doprinose razgradnji lipida (vidjeti Sliku 17-1). Esteri holesterola nastaje u jetri dejstvom acil-CoA-holesterol-aciltransferaza (ACAT). Ovaj enzim katalizira prijenos masnog kiselinskog ostatka iz koenzima A u hidroksilnu grupu holesterola (Sl. 21-38), pretvarajući holesterol u hidrofobniji oblik. Esteri holesterola u izlučenim česticama lipoproteina prenose se u druga tkiva pomoću holesterola ili skladište u jetri.
Sl. 21-38. Sinteza estera holesterola. Eterifikacija čini holesterol još više hidrofobnim oblikom za skladištenje i transport.

Holesterol je potreban svim tkivima rastućeg životinjskog organizma za sintezu membrana, a neki organi (na primjer, nadbubrežna i spolna žlijezda) koriste holesterol kao prekursor steroidnih hormona (o tome će biti govora u nastavku). Holesterol je također prekursor vitamina D (vidi sliku 10-20, stih 1).
Holesterol i drugi lipidi nose lipoproteine iz plazme
Esteori kolesterola i holesterola poput triacilglicerola i fosfolipida u vodi su gotovo netopljivi, međutim, moraju se premjestiti iz tkiva u kojem su sintetizirani, do tkiva u kojem će se skladištiti ili konzumirati. Oni se nose krvotokom u obliku lipoproteini krvne plazme - makromolekularni kompleksi specifičnih proteinskih nosača (apolipoproteini) s fosfolipidima, holesterolom, esterima holesterola i triacilglicerolima prisutnim u ovim kompleksima u različitim kombinacijama.
Apolipoproteini („apo“ se odnosi na sam protein bez lipida) kombiniraju se sa lipidima kako bi formirali nekoliko frakcija lipoproteinskih čestica - sferni kompleksi s hidrofobnim lipidima u središtu i hidrofilni lanci aminokiselina na površini (Sl. 21-39, a). Pomoću različitih kombinacija lipida i proteina nastaju čestice različite gustoće - od hilomikrona do lipoproteina visoke gustoće. Te se čestice mogu odvojiti ultracentrifugiranjem (Tabela 21-1) i vizuelno promatrati pomoću elektronske mikroskopije (Slika 21-39, b). Svaka frakcija lipoproteina obavlja specifičnu funkciju koja se određuje mjesto sinteze, sastavom lipida i sadržajem apolipoproteina. Najmanje 10 različitih apolipoproteina pronađeno je u ljudskoj krvnoj plazmi (Tabela 21-2), koje se razlikuju u veličini, reakcijama sa specifičnim antitijelima i karakterističnoj raspodjeli lipoproteina u različitim klasama. Ove komponente proteina djeluju kao signalne tvari koje usmjeravaju lipoproteine prema specifičnim tkivima ili aktiviraju enzime koji djeluju na lipoproteine.
Tabela 21-1. Lipoproteini humane plazme
Sastav (masni udio,%)
r = 513.000). Čestica LDL sadrži jezgru od otprilike 1.500 molekula estera holesterola, oko jezgre se nalazi školjka od 500 molekula holesterola, 800 molekula fosfolipida i jedna molekula apoB-100. b - četiri klase lipoproteina, vidljivih elektronskim mikroskopom (nakon manifestacije negativa). U smjeru kazaljke na satu, počevši od gornje lijeve slike: hilomikroni - s promjerom od 50 do 200 nm, PL O NP - od 28 do 70 nm, HDL - od 8 do 11 nm, a LDL - od 20 do 55 nm. Svojstva lipoproteina data su u tabeli. 21-2.

Hilomikroni, naveden u Sec. 17, premjestite hranu triacilglicerole iz crijeva u druga tkiva. To su najveći lipoproteini, oni imaju najnižu gustoću i najveći relativni sadržaj triacilglicerola (vidi Sl. 17-2). Hilomikroni se sintetišu u ER epitelnih ćelija koje pokrivaju tanko crijevo, zatim se premještaju kroz limfni sustav i ulaze u krvotok kroz lijevu subklavijsku venu. Hilomikronski apolipoproteini sadrže apoB-48 (jedinstven za ovu klasu lipoproteina), apoE i apoC-II (Tabela 21-2). AroC-II aktivira lipoprotein lipazu u kapilarima masnog tkiva, srca, skeletnih mišića i mliječne žlijezde koji doje, osiguravajući protok slobodnih masnih kiselina u ta tkiva. Tako hilomikroni prebacuju hranu masne kiseline u tkiva, gde će se trošiti ili skladištiti kao gorivo (Sl. 21-40). Ostaci hilomikrona (uglavnom oslobođeni triacilglicerola, ali još uvek sadrže holesterol, apoE i apoB-48) krvotokom se prenose u jetru. U jetri se receptori vežu za apoE koji se nalaze u ostacima hilomikrona i posreduju njihovu apsorpciju endocitozom. U hepatocitima ti ostaci oslobađaju holesterol koji sadrže i uništavaju se u lizosomima.
Tabela 21-2. Apolipoproteini humane plazme u plazmi
Funkcija (ako je poznata)
Aktivira L CAT, komunicira s ABC transporterom
Inhibira L CAT
Aktivira L CAT, transport / klirens holesterola
Veže se za LDL receptor
Hilomikroni, VLDL, HDL
Hilomikroni, VLDL, HDL
Hilomikroni, VLDL, HDL
Započinje uklanjanje ostataka VLDL i hilomikrona
Kad hrana sadrži više masnih kiselina nego što se trenutno može upotrijebiti kao gorivo, u jetri se pretvaraju u triacilglicerole koji stvaraju frakciju sa specifičnim apolipoproteinima lipoproteini vrlo niske gustine (VLDL). Prekomjerni ugljikohidrati u jetri također se mogu pretvoriti u triacilglicerole i izvesti kao VLDL (Sl. 21-40, a).Pored triacilglicerola, frakcija VLDL sadrži određenu količinu estera holesterola i holesterola, kao i apoB-100, apoC-1, apoC-II, apoC III i apoE (Tabela 21-2). Ti lipoproteini se takođe prenose krvlju iz jetre u mišićno i masno tkivo gdje se, nakon što se lipoprotein lipaza aktivira apo-C II, slobodne masne kiseline oslobađaju iz triacilglicerola frakcije VLDL. Adipociti hvataju slobodne masne kiseline, ponovo ih pretvaraju u triacilglicerole, koji se u tim stanicama pohranjuju u obliku lipidnih inkluzija (kapi), miociti, naprotiv, odmah oksidiraju masne kiseline kako bi stvorili energiju. Većina VLDL ostataka eliminira se iz cirkulacije hepatocitima. Njihova apsorpcija je slična apsorpciji hilomikrona posredovana receptorima i ovisi o prisutnosti apoE u VLDL ostacima (u dodatku 21-2 opisan je odnos apoE i Alzheimerove bolesti).
Sl. 21-40. Lipoproteini i transport lipida i - lipidi se prenose krvotokom u obliku lipoproteina koji se kombiniraju u nekoliko frakcija različitih funkcija i različitog sastava proteina i lipida (tab. 21-1, 21-2) i odgovara gustoći tih frakcija. Lipidi hrane se agregiraju u hilomikrone, većina triacilglicerola sadržanih u njima oslobađa se lipoprotein lipazom u masno tkivo i u kapilare. Ostaci hilomikrona (koji sadrže uglavnom proteine i holesterol) uzimaju se hepatociti. Endogeni lipidi i holesterol iz jetre dostavljaju se u masno i mišićno tkivo u obliku VLDL. Oslobađanje lipida iz VLDL (zajedno s gubitkom nekih apolipoproteina) postepeno pretvara VLDLP u LDL, koji dostavlja kolesterol u ekstrahepatička tkiva ili ga vraća u jetru. Jetra privlači ostatke VLDL, LDL i ostatke hilomikrona pomoću endocitoze posredovane receptorima. Višak holesterola u ekstrahepatičkim tkivima se prenosi u jetru u obliku LDL-a. U jetri se dio holesterola pretvara u žučne soli. b - uzorci krvne plazme uzet nakon gladovanja (lijevo) i nakon jela hranu s visokim udjelom masti (desno). Hilomikroni nastali jedenjem masne hrane daju plazmi vanjsku sličnost s mlijekom.

Uz gubitak triacilglicerola, dio VLDL se pretvara u VLDL ostatke, koji se nazivaju i lipoproteini srednje gustoće (VLDL), a daljnje uklanjanje triacilglicerola iz VLDL daje lipoproteini niske gustine (LDL) (tab. 21-1). LDL frakcija, koja je vrlo bogata esterima holesterola i holesterola, a sadrži i apoB-100, prenosi holesterol u ekstrahepatička tkiva koja na svojim plazma membranama nose specifične receptore koji prepoznaju apoB-100. Ovi receptori posreduju unosu holesterola i estera holesterola (kao što je opisano u nastavku).
Dodatak 21-2.ApoE aleli određuju učestalost Alzheimerove bolesti
U ljudskoj populaciji postoje tri poznate varijante (tri alela) gena koji kodira apolipoprotein E. Od alela apoE u ljudi najčešći je alel APOEZ (oko 78%), aleli APOE4 i APOE2 sa 15 i 7%. Alel APOE4 posebno je karakterističan za ljude koji boluju od Alzheimerove bolesti, a taj odnos omogućuje predviđanje pojave bolesti s velikom vjerovatnoćom. Ljudi koji su naslijedili APOE4 imaju visoki rizik za razvoj kasne Alzheimerove bolesti. Ljudi homozigotni za APOE4 imaju 16 puta veću vjerojatnost da će razviti bolest, prosječna dob onih koji se razbolevaju je oko 70 godina. Za ljude koji naslijede dvije kopije AROEZ-a, naprotiv, prosječna dob Alzheimerove bolesti prelazi 90 godina.
Molekularna osnova povezanosti apoE4 i Alzheimerove bolesti još uvijek nije poznata. Povrh toga, još uvijek nije jasno kako apoE4 može utjecati na rast amiloidne vrpce, koji su očito glavni uzročnik Alzheimerove bolesti (vidi Sl. 4-31, v. 1). Pretpostavke se usredotočuju na moguću ulogu apoE u stabilizaciji strukture citoskeleta neurona. ApoE2 i apoEZ proteini vežu se za brojne proteine povezane sa mikrotubulama neurona, dok apoE4 ne veže. Ovo može ubrzati smrt neurona. Ma kakav se ovaj mehanizam pokazao, ova zapažanja daju nadu za širenje našeg razumevanja bioloških funkcija apolipoproteina.
Četvrta vrsta lipoproteina - lipoproteini visoke gustoće (HDL), ovaj se udio formira u jetri i tankom crijevu u obliku sitnih čestica bogatih proteinima koji sadrže relativno malo kolesterola i potpuno bez estera holesterola (Sl. 21-40). HDL frakcija sadrži apoA-I, apoC-I, apoC-II i druge apolipoproteine (Tabela 21-2), kao i lecitin-holesterol-aciltransferaza (LC AT), koji katalizira stvaranje estera holesterola iz lecitina (fosfatidilholina) i holesterola (sl. 21-41). L CAT na površini novoformiranih HDL čestica pretvara hilomikronski holesterol i fosfatidilholin i VLDL ostatke u estere holesterola, koji počinju formirati jezgro, pretvarajući novoformirane diskoidne HDL čestice u zrele sferne HDL čestice. Ovaj lipoprotein bogat holesterolom se zatim vraća u jetru, gde se holesterol "izbacuje", deo ovog holesterola se pretvara u žučne soli.
Sl. 21-41. Reakcija katalizirana lecitin-holesterolom-aciltransferazom (L CAT). Ovaj enzim prisutan je na površini HDL čestica i aktivira se apoA-1 (komponenta HDL frakcije). Esteri holesterola se nakupljaju u novostvorenim česticama HDL-a, pretvarajući ih u zreli HDL.

HDL se može apsorbirati u jetri pomoću endocitoze posredovane receptorima, ali barem se neki od HDL holesterola drugim mehanizmima dostavlja u druga tkiva. Čestice HDL mogu se vezati za proteine SR - BI receptora na plazma membrani ćelija jetre i u steroidogenom tkivu kao što su nadbubrežne žlezde. Ovi receptori ne posreduju endocitozu, već djelomični i selektivni prijenos holesterola i drugih lipida HDL frakcije u ćeliju. "Osiromašeni" HDL frakcija ponovo ulazi u krvotok, gdje uključuje nove dijelove lipida iz hilomikrona i VLDL ostataka. Isti HDL takođe može uhvatiti holesterol pohranjen u ekstrahepatičkim tkivima i prenijeti ga u jetru obrnuti transport holesterola (Sl. 21-40). U jednoj od varijanti obrnutog transporta, interakcija rezultirajućeg HDL-a sa SR-BI receptorima u stanicama bogatim holesterolom inicira pasivnu difuziju holesterola sa stanične površine u čestice HDL-a koje potom kolesterol prebacuju natrag u jetru. U drugoj varijanti obrnutog transporta u bogatoj kolesterolom ćelijom, nakon cijepanja HDL-a, apoA-I stupa u interakciju s aktivnim transporterom, ABC proteinom. ApoA-I (i vjerojatno HDL) apsorbira se endocitozom, zatim se ponovo izlučuje, napunjen holesterolom, koji se transportira u jetru.
Protein ABC1 je dio velike porodice nosilaca mnogih lijekova, ti se nosači ponekad nazivaju i ABC transporteri, jer svi sadrže ATP-vezujuće kasete (ATP - kasete koje vežu), a imaju i dvije transmembranske domene sa šest transmembranskih helikoptera (vidi poglavlje. Pogl. 11, stih 1). Ovi proteini aktivno prenose mnoge ione, aminokiseline, vitamine, steroidne hormone i žučne soli kroz plazma membrane. Drugi predstavnik ove porodice nosilaca je CFTR protein, koji je sa cističnom fibrozom oštećen (vidjeti dodatak 11-3, v. 1).
Esteri holesterola ulaze u ćeliju putem endocitoze posredovane receptorima
Svaka LDL čestica u krvotoku sadrži apoB-100, koji je prepoznatljiv po specifičnim proteinima površinskih receptora -LDL receptori na membrani ćelija koje trebaju da uhvate holesterol. Vezanje LDL na LDL receptor pokreće endocitozu, zbog koje se LDL i njegov receptor kreću u ćeliju unutar endosoma (Sl. 21-42). Endosom se na kraju stapa s lizosomom, koji sadrži enzime koji hidroliziraju estere holesterola, oslobađajući holesterol i masne kiseline u citosol. ApoB-100 iz LDL se takođe razgrađuje da formira aminokiseline koje se izlučuju u citosol, ali LDL receptor izbjegava degradaciju i vraća se na staničnu površinu kako bi ponovo sudjelovao u unosu LDL. ApoB-100 je također prisutan u VLDL-u, ali njegova domena koja se veže za receptor nije u stanju da se veže za LDL receptor; konverzija VLDLP u LDL čini domenu koja veže receptor u apoB-100 pristupačnom. Taj put prenosa holesterola u krvi i njegova endocitoza posredovana receptorima u ciljanim tkivima proučavali su Michael Brown i Joseph Goldstein.
Michael Brown i Joseph Goldstein

Sl. 21-42. Hvatanje holesterola endocitozom posredovanom receptorima.

Holesterol, koji na taj način ulazi u ćelije, može se ugraditi u membrane ili ih ACAT (re-esterificirati) ponovo ukloniti (Sl. 21-38) za čuvanje u citosolu unutar kapljica lipida. Kad ima dovoljno kolesterola u LDL frakciji krvi, nagomilava se višak unutarćelijskog kolesterola smanjenjem brzine njegove sinteze.
LDL receptor se takođe veže na apoE i igra značajnu ulogu u unosu hilomikrona i VLDL ostataka u jetri. Međutim, ako LDL receptori nisu dostupni (kao na primjer, u mišjem soju koji nedostaje gen LDL receptora), VLDL ostaci i hilomikroni i dalje se apsorbiraju u jetri, iako se LDL ne apsorbira. To ukazuje na prisustvo pomoćnog rezervnog sistema za endocitozu posredovanu receptorima VLDL i hilomikronske ostatke. Jedan od rezervnih receptora je protein LRP (protein povezan sa lipoproteinskim receptorima), koji je povezan sa receptorima lipoproteina, koji se veže za apoE i brojne druge ligande.
Nekoliko nivoa regulacije biosinteze holesterola
Sinteza kolesterola je složen i energetski skup proces, tako da je jasno da je tijelu korisno imati mehanizam za regulaciju biosinteze holesterola, koji svoju količinu nadopunjuje osim onoga što dolazi s hranom. U sisara je proizvodnja holesterola regulisana unutarćelijskom koncentracijom
holesterol i hormoni glukagon i inzulin. Stupanj pretvorbe HMG - CoA u mevalonat (Sl. 21-34) ograničava brzinu u metaboličkom putu stvaranja kolesterola (glavna točka regulacije). Ovu reakciju katalizira HMG - CoA reduktaza. Regulacija kao odgovor na promjene razine kolesterola posreduje elegantnim sistemom regulacije transkripcije za gen koji kodira HMG - CoA reduktazu. Ovaj gen, zajedno s više od 20 drugih gena koji kodiraju enzime koji sudjeluju u apsorpciji i sintezi kolesterola i nezasićenih masnih kiselina, kontrolira mala porodica proteina nazvanih proteini koji stupaju u interakciju sa sterol-regulatornim elementom stvaranja proteina (SREBP, sterolni regulatorni element koji veže proteine) . Nakon sinteze, ovi proteini se uvode u endoplazmatski retikulum. Jedina topiva amino-terminalna SREBP domena funkcionira kao aktivator transkripcije koristeći mehanizme opisane u pogl. 28 (stih 3). Međutim, ovaj domen nema pristup jezgru i ne može učestvovati u aktivaciji gena sve dok ostaje u molekuli SREBP. Kako bi se aktivirala transkripcija HMG gena - CoA reduktaze i drugih gena, transkriptivno aktivna domena se odvaja od ostatka SREBP proteolitičkim cijepanjem. Kad je kolesterol visok, SREBP proteini su neaktivni, fiksirani su na ER u kompleksu s drugim proteinom zvanim SCAP (SREBP - protein koji aktivira cijepanje) (Sl. 21-43). SCAP veže holesterol i brojne druge sterole, djelujući kao sterol senzor. Kad je nivo sterola visok, SCAP - SREBP kompleks vjerovatno djeluje s drugim proteinom, koji zadržava cijeli kompleks u ER. Kada nivo sterola u ćeliji padne, konformaciona promena SCAP dovodi do gubitka zadržavajuće aktivnosti, a SCAP - SREBP kompleks prelazi unutar vezikula u Golgijev kompleks. U kompleksu Golgi, SREBP proteini dva puta se cepaju sa dve različite proteaze, a drugo cepanje oslobađa amino-terminalnu domenu u citosolu. Ova domena prelazi u jezgro i aktivira transkripciju ciljnih gena. Domen proteina s amino-terminalnim SREBP ima kratak poluživot i brzo se razgrađuje proteasomima (vidi Sl. 27-48, t. 3). Kad se nivo sterola dovoljno poveća, proteolitičko oslobađanje proteina SR EBP domena s amino završetkom ponovo se blokira, a proteasomska razgradnja postojećih aktivnih domena dovodi do brzog isključivanja ciljnih gena.
Sl. 21-43. Aktivacija SR EBP. SREB P proteini koji stupaju u interakciju sa elementom reguliranim sterolom (zelena boja), odmah nakon sinteze, uvode se u ER, tvoreći kompleks sa S CAP (crvena boja). (N i C označuju aminske i karboksilne krajeve proteina.) U stanju vezanom za S-CAP, proteini SRE BP nisu aktivni. Kad se nivo sterola smanji, SR EBP-S CAP kompleks prelazi na Golgijev kompleks, a proteini SR EBP se sekvencijalno cijepaju dvije različite proteaze. Oslobođeni terminalni aminokiselinski domen SR EBP migrira u jezgro, gde aktivira transkripciju gena regulisanih sterolom.

Sinteza kolesterola je također regulirana s nekoliko drugih mehanizama (Sl. 21-44). Hormonska kontrola posredovana je kovalentnom modifikacijom NM G-CoA reduktaze. Ovaj enzim postoji u fosforiliranom (neaktivnom) i dephosforiliranom (aktivnom) obliku. Glukagon potiče fosforilaciju (inaktivaciju) enzima, a inzulin potiče defosforilaciju, aktiviranje enzima i favoriziranje sinteze kolesterola. Visoke unutarćelijske koncentracije holesterola aktiviraju ASAT, čime se povećava esterifikacija holesterola za taloženje. Konačno, visoka razina ćelijskog holesterola inhibira transkripciju gena koji kodira LDL receptor, smanjujući proizvodnju ovog receptora i, samim tim, unos holesterola iz krvi.
Sl. 21-44. Regulacija nivoa holesterola omogućava ravnotežu između sinteze i apsorpcije holesterola iz hrane. Glukagon olakšava fosforilaciju (inaktivaciju) NM G -CoA reduktaze, inzulin potiče dephosforilaciju (aktivaciju). X - neidentifikovani metaboliti holesterola koji podstiču proteolizu NM G -CoA reduktaze.

Neregulirani holesterol može dovesti do ozbiljnih bolesti kod ljudi. Kada ukupna količina sintetiziranog kolesterola i kolesterola dobivena iz hrane prelazi količinu potrebnu za sastavljanje membrane, sintezu žučnih soli i steroida, mogu se pojaviti patološka nakupljanja kolesterola u krvnim žilama (aterosklerotski plakovi), što dovodi do njihove blokade (ateroskleroza). U industrijaliziranim zemljama glavni je uzrok smrtnosti srčani zastoj zbog opstrukcije koronarnih arterija. Razvoj ateroskleroze povezan je s visokim nivoom kolesterola u krvi, a posebno s visokim kolesterolom koji tolerira LDL frakcija; visoki nivo HDL u krvi, naprotiv, povoljno utječe na stanje krvnih žila.
Uz nasljednu hiperholesterolemiju (genetsku manu) nivo holesterola u krvi je vrlo visok - kod ovih ljudi se razvija ozbiljna ateroskleroza već u dječjoj dobi. Zbog neispravnog LDL receptora dolazi do nedovoljnog unosa LDL kolesterola posredovanog receptorima. Kao rezultat toga, holesterol se ne uklanja iz krvotoka, on se nakuplja i doprinosi stvaranju aterosklerotskih plakova. Sinteza endogenog holesterola se nastavlja, uprkos višku holesterola u krvi, jer vanćelijski holesterol ne može ući u ćeliju da reguliše unutarćelijsku sintezu (Sl. 21 -44).Za liječenje bolesnika sa nasljednom hiperholesterolemijom i drugim bolestima povezanim sa povišenim serumskim holesterolom koriste se klase statina. Neki se dobivaju iz prirodnih izvora, dok ih drugi sintetizira farmaceutska industrija. Statini su slični mevalonatu (dodavanje 21-3) i konkurentni su inhibitori NMS-CoA reduktaze.
Dodatak 21-3. MEDICINA. Lipidna hipoteza i stvaranje statina
Koronarna bolest srca (CHD) glavni je uzrok smrtnosti u razvijenim zemljama. Sužavanje koronarnih arterija koje dovode krv u srce nastaje kao rezultat stvaranja masnih naslaga koje se nazivaju aterosklerotični plakovi; ti plakovi sadrže holesterol, fibrilarne proteine, kalcijum, trombocite trombocita i fragmente ćelija. U XX veku. Izvela se aktivna rasprava o vezi između arterijske opstrukcije (ateroskleroze) i holesterola u krvi. Ove rasprave i aktivna istraživanja u ovom pravcu doveli su do stvaranja efikasnih lijekova koji snižavaju holesterol.
1913. N.N.Aničkov, poznati ruski naučnik i stručnjak na polju eksperimentalne patologije, objavio je rad u kojem je pokazao da zečevi koji su hranjeni hranom bogatom holesterolom razvijaju oštećenja krvnih žila koje podsećaju na aterosklerotske plakove u sudovima starijih ljudi. Anichkov je vodio svoje istraživanje nekoliko desetljeća i rezultate je objavio u poznatim zapadnim časopisima. Nažalost, njegovi podaci nisu postali osnova za model razvoja ateroskleroze kod ljudi, jer je u to vrijeme prevladavala hipoteza da je ova bolest prirodni rezultat starenja i da je nije moguće spriječiti. Međutim, dokazi su se postepeno gomilali u odnosu između serumskog holesterola i razvoja ateroskleroze (lipidna hipoteza), pa i 1960-ih godina. neki istraživači izričito su naveli da se ova bolest može lečiti lekovima. Međutim, suprotno gledište postojalo je sve dok nisu 1984. godine objavljeni rezultati širokog istraživanja o ulozi kolesterola koje je proveo američki Nacionalni institut za zdravstvo (Coronary Primary Prevention Trial). Dokazano je statistički značajno smanjenje učestalosti infarkta miokarda i šloga sa smanjenjem holesterola u krvi. U ovom istraživanju korišten je holesterol, smola za izmjenu aniona koja veže žučne kiseline i koja se koristi za snižavanje holesterola. Rezultati su stimulirali potragu za novim, snažnijim terapijskim lijekovima. Moram reći da su u znanstvenom svijetu sumnje u valjanost lipidne hipoteze potpuno nestale tek s pojavom statina krajem 80-ih - početkom 1990-ih.
Prvi statin otkrio je Akira Endo u Sankyou u Tokiju. Endo je svoj rad objavio 1976., iako se nekoliko godina bavio problemom metabolizma holesterola. 1971. godine sugerirao je da inhibitori sinteze kolesterola mogu biti sadržani i u proizvođačima antibiotika koji su u to vrijeme proučavani. Tijekom nekoliko godina intenzivnog rada, analizirao je više od 6 000 kultura raznih gljiva, dok nije došao do pozitivnog rezultata. Dobijeni spoj nazvan je kompaktin. Ova supstanca snizila je holesterol kod pasa i majmuna. Ove su studije privukle pažnju Michaela Browna i Josepha Goldsteina sa Medicinskog fakulteta Univerziteta u Teksasu na Teksasu. Brown i Goldstein su zajedno sa Endom započeli zajedničku studiju i potvrdili njegove podatke. Glavni uspjesi prvih kliničkih ispitivanja uključili su farmaceutske kompanije u razvoj ovih novih lijekova. U Mercku je tim pod vodstvom Alfreda Albertsa i Roya Wagelosa pokrenuo novi skrining kultura gljiva i, kao rezultat analize ukupno 18 kultura, otkrio je još jedan aktivni lijek. Nova supstanca se zove lovastatin. Međutim, istovremeno se smatralo da davanje velikih doza kompaktina psima dovodi do razvoja karcinoma i potrage za novim statinima 1980-ih. je suspendovan. Međutim, do tada, prednosti upotrebe statina za liječenje bolesnika s porodičnom hiperholesterolemijom su već bile očite. Nakon brojnih savjetovanja s međunarodnim stručnjacima i Upravi za hranu i lijekove (FDA, SAD), Merck je počeo razvijati lovastatin. Opsežne studije u naredne dvije decenije nisu otkrile kancerogeni učinak lovastatina i nove generacije lijekova koji su se pojavili nakon njega.
Sl. 1. Statini su inhibitori NM G-CoA reduktaze. Usporedba strukture mevalonata i četiri farmaceutska proizvoda (statini) koji inhibiraju djelovanje NM G -CoA reduktaze.

Statini inhibiraju djelovanje HMG - CoA - reduktaze, oponašajući strukturu mevalonata i na taj način blokira sintezu holesterola. U bolesnika s hiperholesterolemijom uzrokovanom defektom jedne kopije gena receptora LDL, pri uzimanju lovastatina nivo kolesterola se smanjuje za 30%. Lijek je još efikasniji u kombinaciji sa specijalnim smolama koje vežu žučne kiseline i sprečavaju njihovu reverznu apsorpciju iz crijeva.
Trenutno se statini najčešće koriste za snižavanje holesterola u plazmi u krvi. Prilikom uzimanja bilo kojeg lijeka, postavlja se pitanje o njihovim nepoželjnim nuspojavama. Međutim, kod statina mnoge su nuspojave za razliku od njih pozitivne. Ovi lijekovi mogu potaknuti protok krvi, popraviti već postojeće aterosklerotske plakove (tako da se ne odvajaju od zidova krvnih žila i ne ometaju protok krvi), inhibiraju agregaciju trombocita, a također slabe upalne procese u zidovima krvnih žila. U pacijenata koji prvi put uzimaju statine, ti se efekti manifestuju i prije nego što nivo kolesterola počne opadati i verovatno je povezan sa inhibicijom sinteze izoprenoida. Naravno, nije svaka nuspojava statina korisna. Kod nekih bolesnika (obično među onima koji uzimaju statine u kombinaciji s drugim lijekovima koji snižavaju kolesterol) može se javiti bol u mišićima i slabost mišića, a ponekad i u prilično jakom obliku. Registrirane su i druge prilično brojne nuspojave statina koje se, na sreću, rijetko javljaju. U ogromnoj većini pacijenata uzimanje statina može inhibirati razvoj kardiovaskularnih bolesti. Kao i bilo koji drugi lijek, statine treba koristiti samo prema preporuci ljekara.

S nasljednim odsustvom HDL holesterola, nivo holesterola je vrlo nizak, s Tangerijevom bolešću holesterol se praktično ne određuje. Oba genetska poremećaja su rezultat mutacija proteina ABC1. Frakcija holesterola bez HDL-a ne može da uhvati holesterol iz ćelija sa nedostatkom ABC1, a ćelije koje smanjuju holesterol brzo se uklanjaju iz krvi i uništavaju. I nasljedna odsutnost HDL-a i Tangierove bolesti vrlo su rijetke (manje od 100 porodica s Tangierovom bolešću poznato je širom svijeta), ali ove bolesti pokazuju ulogu ABC1 proteina u regulaciji razine HDL u plazmi. Budući da niska razina HDL u plazmi korelira s velikom stopom oštećenja koronarnih arterija, protein ABC1 može biti koristan cilj za lijekove dizajnirane za regulaciju razine HDL-a. ■
Steroidni hormoni nastaju cijepanjem bočnog lanca kolesterola i njegovom oksidacijom.
Čovjek prima sve svoje steroidne hormone iz holesterola (Sl. 21-45). Dvije klase steroidnih hormona sintetišu se u kore nadbubrežne žlijezde: mineralkortikoidi,koji regulišu apsorpciju anorganskih jona (Na +, Cl - i HC O 3 -) u bubrezima, i glukokortikoidi, koji pomažu u regulaciji glukoneogeneze i smanjuju upalni odgovor. Spolni hormoni proizvode se u reproduktivnim ćelijama muškaraca i žena te u posteljici. Među njima progesteron koji reguliše ženski reproduktivni ciklus, androgeni (npr. testosteron) i estrogeni (estradiol) koji utiču na razvoj sekundarnih seksualnih karakteristika kod muškaraca, odnosno žena. Steroidni hormoni imaju učinak u vrlo malim koncentracijama i zbog toga se sintetišu u relativno malim količinama. U odnosu na žučne soli troši se relativno malo kolesterola za proizvodnju steroidnih hormona.

Sl. 21-45. Neki steroidni hormoni nastaju iz holesterola. Strukture nekih od ovih spojeva prikazane su na Sl. 10-19, stih 1.

Sinteza steroidnih hormona zahteva uklanjanje nekoliko ili svih atoma ugljenika u „bočnom lancu“ C-17 D-prstena holesterola. Uklanjanje bočnog lanca događa se u mitohondrijama steroidogenih tkiva. Postupak uklanjanja sastoji se od hidroksilacije dva susjedna atoma ugljika bočnog lanca (C-20 i C-22), zatim cijepanja veze između njih (Sl. 21-46). Stvaranje različitih hormona uključuje i uvođenje atoma kisika. Sve reakcije hidroksilacije i oksidacije tijekom biosinteze steroida kataliziraju oksidaze mješovite funkcije (dodavanje 21-1) koje koriste NA D PH, O 2 i mitohondrijski citokrom P-450.
Sl. 21-46. Cijepanje bočnog lanca u sintezi steroidnih hormona. U ovom sustavu oksidaze sa miješanom funkcijom koja oksidira susjedne atome ugljika, citokrom P-450 djeluje kao nosač elektrona. Takođe su u procesu uključeni proteini koji prenose elektrone, adrenodoksin i adrenodoksin reduktaza. Ovaj sistem bočnog cijepanja pronađen je u mitohondrijama nadbubrežne kore, gdje se odvija aktivna proizvodnja steroida. Pregnenolon je prekursor svih ostalih steroidnih hormona (Sl. 21-45).

Intermedijeri biosinteze holesterola uključeni su u mnoge druge metaboličke puteve.
Uz ulogu posrednika u biosintezi kolesterola, izopentenil pirofosfat služi kao aktivirani prekursor u sintezi ogromnog broja biomolekula koje obavljaju različite biološke funkcije (sl. 21-47). Tu spadaju vitamini A, E i K, biljni pigmenti poput karotena i fitola lanca klorofila, prirodna guma, mnoga esencijalna ulja (na primjer, mirisna baza limunovog ulja, eukaliptusa, mošusa), hormon insekata maloljetnika koji regulira metamorfozu, doliholi, koji služe kao nosioci rastvorljivi u lipidima u složenoj sintezi polisaharida, ubikinona i plastokinona - nosača elektrona u mitohondrijama i hloroplastima. Svi ovi molekuli su u strukturi izoprenoidi. U prirodi je pronađeno više od 20 000 različitih izoprenoida, a stotine novih javlja se svake godine.
Sl. 21-47. Ukupna slika biosinteze izoprenoida. Strukture većine ovdje predstavljenih krajnjih proizvoda date su u poglavlju. 10 (stih 1).

Prenilacija (kovalentno vezivanje izoprenoida, vidi Sl. 27-35) je uobičajeni mehanizam kojim se proteini usidre na unutrašnjoj površini ćelija sisavaca (vidi Sl. 11-14). U nekim proteinima, vezani lipid je predstavljen farnesilnom grupom od 15 ugljika, u drugim je 20-ugljikova geranil-geranilna skupina. Ove dvije vrste lipida vezuju različite enzime. Moguće je da reakcije prenilacije usmjeravaju proteine na različite membrane ovisno o tome koji je lipid povezan. Prilinacija proteina je druga važna uloga derivata izoprena - učesnika metaboličkog puta holesterola.
Sažetak odeljka 21.4 Biosinteza holesterola, steroida i izoprenoida
■ Holesterol se stvara iz acetil-CoA u složenom reakcijskom nizu putem intermedijara kao što su β-hidroksi-β-metilglutaril-CoA, mevalonat, dva aktivirana izoprenska dimetilalil pirofosfat i izopentenil pirofosfat. Kondenzacija izoprenskih jedinica daje neciklički skvalen, koji ciklizira u obliku kondenziranog prstenastog sistema i steroidnog bočnog lanca.
■ Sinteza holesterola je pod hormonskim nadzorom i, osim toga, inhibira se povećanjem koncentracija unutarćelijskog holesterola, što nastaje kovalentnom modifikacijom i regulacijom transkripcije.
■ Holesterol i esteri holesterola u krvi se nose kao lipoproteini u plazmi. VLDL frakcija prenosi holesterol, estere holesterola i triacilglicerole iz jetre u druga tkiva, gdje se triacilgliceroli cijepaju lipoprotein lipazom, a VLDL se pretvara u LDL. LDL frakcija obogaćena holesterolom i esterima holesterola je indirektno zarobljena receptorima endocitozom, dok apolipoprotein B-100 u LDL prepoznaju receptore plazma membrane. HDL uklanjaju holesterol iz krvi, prenoseći ga u jetru. Prehrambeni uvjeti ili genetske nedostatke metabolizma kolesterola mogu dovesti do ateroskleroze i infarkta miokarda.
■ Steroidni hormoni (glukokortikoidi, mineralokortikoidi i polni hormoni) stvaraju se iz holesterola promjenom bočnog lanca i unošenjem atoma kisika u steroidni sistem prstenova. Mnoga druga izoprenoidna jedinjenja proizvode se iz mevalonata kondenzacijom izopentenil pirofosfata i dimetilalil pirofosfata zajedno sa holesterolom.
■ Prenilacija određenih proteina usmerava ih na mesta vezivanja sa staničnim membranama i važna je za njihovu biološku aktivnost.
Pitanje 48. Regulacija metabolizma visokih masnih kiselina (β-oksidacija i biosinteza). Sinteza malonil CoA. Acetil CoA karboksilaza, regulacija njene aktivnosti. Transport acila Co-a kroz unutrašnju membranu mitohondrija.
Glavni
potroši se količina fenilalanina
na 2 načina:
uključi
u vjevericama,
skreće
u tirozinu.
Okretanje
fenilalanin prvenstveno tirozin
potrebno za uklanjanje viška
fenilalanin, s obzirom na visoke koncentracije
Otrovno je za stanice. Obrazovanje
tirozin zapravo nije važan
jer nedostatak ove aminokiseline
u ćelijama to se praktično ne događa.
Glavni
započinje metabolizam fenilalanina
njegovom hidroksilacijom (sl. 9-29), u
rezultirajući tirozinom.
Tu reakciju katalizira specifičan
monooksi-nase - fenilalanin hidra (zsilaza,
koja služi kao koproducent
tetrahidrobiopterin (N4BP).
Aktivnost enzima takođe zavisi od toga
prisutnost Fe2.
In
jetra je prvenstveno ubrzana mobilizacija
glikogena (vidjeti dio 7). Međutim zalihe
glikogen u jetri je potrošen
18-24 sata posta. Glavni izvor
glukoza kako zalihe ponestaju
glikogen postaje glukoneogeneza,
koja počinje da ubrzava kroz
Sl.
11-29. Velike metaboličke promjene
energije prilikom izmjene apsorbenata
postabsorbent stanje. CT
- ketonska tela, FA - masne kiseline.
4-6 h
posle poslednjeg obroka. Podloge
glicerol se koristi za sintezu glukoze,
aminokiseline i laktat. Na visokoj
brzina sinteze koncentracije glukagona
smanjene masne kiseline zbog
fosforilacija i inaktivacija
acetil CoA karboksilaza i stopa
p-oksidacija se povećava. Međutim,
pojačana opskrba masti jetrom
kiseline koje se prevoze
iz depoa masti. Formiran je acetil-CoA
u oksidaciji masnih kiselina koristi se
u jetri za sintezu ketonskih tela.
In
masno tkivo sa povećanjem koncentracije
smanjena brzina sinteze glukagonom
Potiče se TAG i lipoliza. Stimulacija
lipoliza - rezultat aktivacije
hormonski osetljiva TAG lipaza
adipociti pod uticajem glukagona.
Masne kiseline postaju važne
izvori energije u jetri, mišićima i
masno tkivo.
Dakle
dakle, u periodu postabsorpcije
koncentracija glukoze u krvi se održava
na nivou od 80-100 mg / dl, a nivo masnoća
povećava se kiselina i ketonska tela.
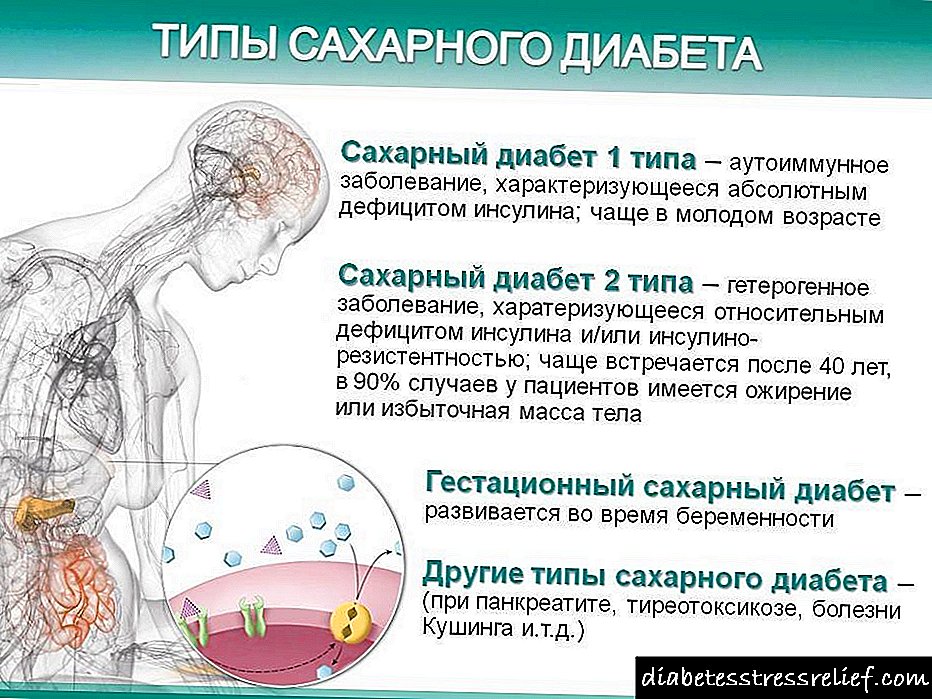
Šećer
dijabetes je bolest koja se javlja
zbog apsolutnog ili relativnog
nedostatak inzulina.
A.
Glavni klinički oblici šećera
dijabetes
Prema
Svjetska organizacija
zdravstvena dijabetesa
razvrstani prema razlikama
genetskih faktora i kliničkih
dva glavna oblika: dijabetes
Tip I - inzulinski ovisan (IDDM) i dijabetes
Tip II - neinzulinski neovisan (NIDDM).
Uredba
sinteza zhk. Regulativni enzim
sinteza lcd - acetil CoA karboksilaze.
Ovaj enzim je regulisano nekoliko
načine.
Aktivacija / disocijacija
enzimske podjedinice kompleksa. In
neaktivni oblik acetil CoA karboksilaze
predstavlja zasebne komplekse,
od kojih se svaka sastoji od 4 podjedinice.
Aktivator enzima je citrat. Stimuliše
kao rezultat, kombinacija kompleksa
pri čemu se povećava aktivnost enzima
. Inhibitor-palmitoil-CoA. On zove
složena disocijacija i smanjenje
aktivnost enzima.
Fosforilacija / Dephosforilacija
acetil CoA karboksilaza. In
stanje postabsorpcije ili u
fizički rad glukagoniziran
adrenalin kroz adenilat ciklazu
sistem se aktivira prokinazom A i
stimulišu podjedinicu fosforilacije
acetil CoA karboksilaza. Fosforiliran
enzim je neaktivan i sinteza masti
kiseline prestaju.
Apsorbent
period inzulin aktivira fosfatazu,
i acetil-CoA karboksilaza prelazi
dephosforilirano stanje. Onda
pod uticajem citrata nastaje
polimerizacija protomera enzima i
on postaje aktivan. Pored aktivacije
enzim, citrat izvodi drugi
funkcija u sintezi LCD-a. Apsorbent
period u mitohondrijama ćelija jetre
nakuplja citrat, u kome
acilni ostatak se prevozi do
citosol.
Uredba
Brzina oksidacije β.
Β -oksidacijsko-metabolički put,
čvrsto vezana za rad CPE i općenito
načine katabolizma. Stoga njegova brzina
regulisano ćelijskim potrebama za
energija tj. prema omjerima ATP / ADP i NADH / NAD, kao i brzini reakcije CPE i
zajednički put katabolizma. Brzina
β-oksidacija u tkivima ovisi o dostupnosti
supstrat, tj.
na količinu masti
kiseline koje ulaze u mitohondrije.
Slobodna koncentracija masnih kiselina
u krvi se podiže nakon aktiviranja
lipoliza u masnom tkivu tokom posta
pod uticajem glukagona i tokom fizičkog
rade pod uticajem adrenalina. U ovim
masne kiseline postaju
prevladavajući izvor energije
za mišiće i jetru, kao rezultat
P-oksidacije nastaju inhibicijom NADH i acetil-CoA
piruvat dehidrogenazni kompleks.
Transformacija formiranja piruvata
od glukoze do acetil-CoA usporava.
Međusobni metaboliti se nakupljaju
glikoliza i posebno glukoza-6-fosfat.
Glukoza-6-fosfat inhibira hekokinazu
i stoga obeshrabruje
upotreba glukoze u tom procesu
glikoliza. Stoga prevladava
upotreba LCD-a kao glavnog izvora
energije u mišićnom tkivu i jetri
štedi glukozu za nervno tkivo i
crvenih krvnih zrnaca.
Brzina oksidacije takođe
ovisi o aktivnosti enzima
karnitin aciltransferaze I.
U jetri je ovaj enzim inhibiran.
malonil CoA, formirana supstanca
s biosintezom lcd. U apsorpcijskom periodu
glikoliza se aktivira u jetri i
povećava se formiranje acetil-CoA
od piruvata. Prva reakcija sinteze
lcd konverzija acetil-CoA u malonil-CoA.
Malonil-CoA inhibira β-oksidaciju LCD-a,
koja se može koristiti za sintezu
masnoća.
Obrazovanje
malonil-CoA iz regulacije acetil-CoA
reakcija u biosintezi lcd. Prva reakcija
sinteza LCD pretvorbe acetil-CoA u
malonil CoA. Katalitički enzim
ova reakcija (acetil Coa karboksilaza),
pripadaju klasi ligaza. On sadrži
kovalentno vezan biotin. U prvom
ko2 kovalentne faze reakcije
veže se za biotin zbog energije
ATP, u fazi 2 COO - prebačen
na acetil-CoA da formira malonil-CoA.
Aktivnost enzima acetil CoA karboksilaze
određuje brzinu svih narednih
reakcije sinteze lc
citrat aktivira enzim u citosolu
acetil CoA karboksilaza. Malonyl CoA u
zauzvrat, inhibira transfer višeg
masne kiseline od citosola do matriksa
aktivnost koja inhibira mitohondrije
vanjski acetil CoA: karnitin aciltransferaza,
čime se isključuje oksidacija višeg
masne kiseline.
Acetil-CoA oksaloacetat →
HS-CoA citrat

HSCOA ATP citrat → Acetil-CoA ADP Pi oksaloacetat
Acetil-CoA
u citoplazmi služi kao početni supstrat
za sintezu lcd-a i oksaloacetata u
citosol prolazi transformacije u
rezultat čega nastaje piruvat.
Biosinteza holesterola
Biosinteza holesterola se javlja u endoplazmatskom retikuluu. Izvor svih atoma ugljika u molekuli je acetil-SCoA, koji ovdje dolazi iz mitohondrija u citratu, baš kao i u sintezi masnih kiselina. Biosinteza holesterola troši 18 ATP molekula i 13 NADPH molekula.
Stvaranje holesterola se događa u više od 30 reakcija, koje se mogu grupirati u više faza.
1. Sinteza mevalonske kiseline.
Prve dvije reakcije sinteze podudaraju se s reakcijama ketogeneze, ali nakon sinteze 3-hidroksi-3-metilglutarila-ScoA, enzim ulazi hidroksimetil-glutaril-ScoA reduktaza (HMG-SCOA reduktaza), formirajući mevalonsku kiselinu.
 |