Lijek Zaltrap: upute za upotrebu
Trgovački naziv leka: Zaltrap
Međunarodno vlasničko ime: Aflibercept
Oblik doziranja: koncentrat za infuziju
Aktivna supstanca: aflibercept
Farmakoterapijska grupa: antitumorsko sredstvo
Farmakološka svojstva:
Antitumorski lijek. Aflibercept je rekombinantni fuzijski protein koji se sastoji od VEGF (endotelnog faktora vaskularnog rasta) koji veže dijelove vanćelijskih domena VEGF 1 receptora i VEGF 2 receptora spojene na Fc domenu (fragment kristabilnog fragmenta) humanog imunoglobulina G1 (IgG1). Aflibercept se proizvodi rekombinantnom DNK tehnologijom upotrebom K-1 sistema za izradu ćelija jajnika kineskog hrčka (CHO). Aflibercept je himerni glikoprotein molekulske mase 97 kDa, glikozilacija proteina dodaje 15% ukupnoj molekulskoj masi, što rezultira ukupnom molekulskom masom aflibercepta od 115 kDa. Endotelni vaskularni faktor rasta A (VEGF-A), endotelni vaskularni faktor rasta B (VEGF-B) i faktor rasta placente (P1GF) pripadaju VEGF porodici angiogenih faktora koji mogu djelovati kao snažni faktori koji utječu na mitogene, hemotaktičke i vaskularne propusnosti za endotelne ćelije. VEGF-A djeluje putem dvije receptorske tirozin kinaze - VEGFR-1 i VEGFR-2, koje se nalaze na površini endotelnih ćelija. P1GF i VEGF-B vežu se samo na tirozin kinazu receptora VEGFR-1, koja se osim prisustva na površini endotelnih ćelija nalazi i na površini leukocita. Prekomjerna aktivacija ovih VEGF-A receptora može dovesti do patološke neovaskularizacije i povećane vaskularne propustljivosti. P1GF je takođe povezan sa razvojem patološke neovaskularizacije i infiltracije tumora od upalnih ćelija. Aflibercept djeluje kao rastvorljivi "receptor-zamka" koji se veže na VEGF-A s većim afinitetom nego nativni VEGF-A receptori, a osim toga se veže i za srodne ligande VEGF-B i P1GF. Aflibercept se vezuje za humani VEGF-A, VEGF-B i P1GF formiranjem stabilnih inertnih kompleksa koji nemaju biološku aktivnost. Djelujući kao "zamka" za ligande, aflibercept sprečava vezanje endogenih liganda na njihove odgovarajuće receptore i tako blokira prijenos signala putem tih receptora. Aflibercept blokira aktivaciju VEGF receptora i proliferaciju endotelnih ćelija, pa tako inhibira stvaranje novih žila koje opskrbljuju tumor kisikom i hranjivim tvarima. Aflibercept se veže na humani VEGF-A (ravnotežna konstanta disocijacije (Cd) je 0,5 pmol za VEGF-A165 i 0,36 pmol za VEGF-A121), na ljudski P1GF (Cd 39 pmol na P1GF-2), na humani VEGF-B (Cd 1,92 pmol) sa stvaranjem stabilnog inertnog kompleksa koji nema prepoznatljivu biološku aktivnost.
Indikacije za upotrebu:
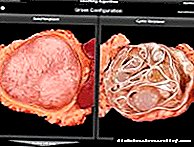
Metastatski kolorektalni karcinom (MKRP) (kod odraslih bolesnika) rezistentan na hemoterapiju koja sadrži oksaliplatin ili napreduje nakon njegove primjene (Zaltrap u kombinaciji sa režimom koji uključuje irinotekan, fluorouracil, kalcijev folinat (FOLFIRI)).
Kontraindikacije:
Preosjetljivost na aflibercept ili bilo koji od pomoćnih sastojaka lijeka Zaltrap, jaka krvarenja, arterijska hipertenzija, rezistentna na lijekove, kronično zatajenje srca III-IV klase (klasifikacija NYHA), teško zatajenje jetre (nedostatak podataka za uporabu), oftalmička uporaba ili uvođenje u staklasto tijelo (zbog hiperosmotičkih svojstava lijeka Zaltrap), trudnoća, razdoblje dojenja, djeca i adolescenti ast 18 godina (zbog nedostatka dovoljno iskustva u primjeni).Mjere predostrožnosti: teško zatajenje bubrega, arterijska hipertenzija, klinički značajne bolesti kardiovaskularnog sistema (CHD, hronična srčana insuficijencija I-II klase prema NYHA klasifikaciji), starija dob, opće stanje ≥2 boda na skali za procjenu općeg stanja pacijenta ECOG ( Istočna združena onkološka grupa).
Doziranje i primjena:
Zaltrap se daje iv u obliku infuzije tokom 1 sata, nakon čega slijedi primjena kemoterapijskog režima FOLFIRI. Preporučena doza Zaltrapa u kombinaciji s kemoterapijskim režimom FOLFIRI iznosi 4 mg / kg tjelesne težine. FOLFIRI kemoterapeutski režim: prvog dana ciklusa - istodobna iv infuzija kroz irinotekanski kateter u obliku slova Y u dozi od 180 mg / m2 tokom 90 min i kalcijevog folinata (racemati s desne i desne strane) u dozi od 400 mg / m2 u trajanju od 2 sata nakon čega slijedi iv (bolusna) primjena fluorouracila u dozi od 400 mg / m2, nakon čega slijedi kontinuirana intravenska infuzija fluorouracila u dozi od 2400 mg / m2 tokom 46 sati, a ciklusi hemoterapije ponavljaju se svaka 2 tjedna. Liječenje Zaltrapom treba nastaviti sve dok bolest ne napreduje ili se ne razvije neprihvatljiva toksičnost.
Nuspojava:
Najčešće primijećene nuspojave (HP) svih stupnjeva ozbiljnosti (s učestalošću od ≥20%) su barem 2% češće sa hemoterapijskim režimom Zaltrap / FOLFIRI nego sa FOLFIRI hemoterapijskim režimom (u opadajućem redoslijedu pojavljivanja): leukopenija, proliv, neutropenija, proteinurija, pojačana aktivnost ACT, stomatitis, umor, trombocitopenija, pojačana aktivnost ALT-a, povišen krvni pritisak, smanjena tjelesna težina, smanjen apetit, krvarenje iz nosa, bol u trbuhu, disfonija, povećana koncentracija kreatinin u serumu i glavobolja. Najčešće su primijećeni sljedeći HP-ovi 3-4 težine (s učestalošću ≥5%), barem 2% češće s kemoterapijskim režimom Zaltrap / FOLFIRI nego s kemoterapijskim režimom FOLFIRI (kako bi se smanjila učestalost): neutropenija, proliv, povišen krvni pritisak, leukopenija, stomatitis, umor, proteinurija i astenija. Općenito, prekid terapije zbog pojave štetnih događaja (svih stupnjeva ozbiljnosti) primijećen je u 26,8% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI u usporedbi s 12,1% pacijenata koji su primali režim hemoterapije FOLFIRI. Najčešći HP-ovi koji su uzrokovali odbacivanje terapije u ≥1% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI bili su astenija / umor, infekcije, proliv, dehidracija, povišen krvni pritisak, stomatitis, venske tromboembolijske komplikacije, neutropenija i proteinurija. Prilagođavanje doze lijeka Zaltrap (smanjenje doze i / ili propusti) provedeno je u 16,7%. Odgađanje kasnijih ciklusa terapije veće od 7 dana uočeno je kod 59,7% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI u poređenju sa 42,6% pacijenata koji su primali režim hemoterapije FOLFIRI. Smrt od drugih uzroka, osim smrti od progresije bolesti, zabilježena u roku od 30 dana nakon posljednjeg ciklusa ispitivanog kemoterapijskog režima, zabilježena je u 2,6% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI i u 1,0% bolesnika koji su primali režim hemoterapije FOLFIRI. Uzrok smrti kod pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI bila je infekcija (uključujući neutropeničnu sepsu) kod 4 pacijenta, dehidracija u 2 pacijenta, hipovolemija kod 1 pacijenta, metabolička encefalopatija kod 1 pacijenta, bolest respiratornog trakta (akutno zatajenje dišnog sustava, aspiraciona pneumonija i plućna tromboembolija) kod 3 bolesnika, gastrointestinalne lezije (krvarenje iz čira na dvanaestopalačnom crevu, upala gastrointestinalnog trakta, potpuna opstrukcija crijeva) kod 3 bolesnika, smrt od nepoznatih pacijenata Doseći kod 2 pacijenta.HP-ove i laboratorijske nepravilnosti primijećene u bolesnika liječenih Zaltrap / FOLFIRI režimom hemoterapije (prema MedDRA) predstavljeni su u nastavku. Podaci HP-a definirani su kao bilo koje neželjene kliničke reakcije ili abnormalnosti u laboratorijskim parametrima, čija je učestalost bila ≥2% veća (za HP svih stupnjeva ozbiljnosti) u grupi aflibercept u usporedbi s placebo skupinom u istraživanju provedenom na pacijentima s ICP-om. Intenzitet HP-a klasificiran je prema NCI CTC (Nacionalnoj ljestvici ocjene opće otrovnosti Instituta za rak) verzije 3.0. Utvrđivanje učestalosti HP-a (prema klasifikaciji WHO): vrlo često (≥10%), često (≥1% - 3 stupnja ozbiljnosti), često astenična stanja (≥3 stupnja ozbiljnosti), rijetko - oštećena zarastanja rana (divergencija ivica rana , neuspjeh anastomoza) (svi stupnjevi ozbiljnosti i ≥3 stepena ozbiljnosti).
Laboratorijski i instrumentalni podaci: vrlo često - povećana aktivnost ACT, ALT (svi stupnjevi ozbiljnosti), smanjena tjelesna masa (svi stupnjevi ozbiljnosti), često - povećana aktivnost ACT, ALT ≥3 stupnja ozbiljnosti, smanjena tjelesna težina ≥3 stupnja težine.
Interakcija s drugim lijekovima:
Formalna ispitivanja interakcije lijekova sa Zaltrapom nisu provedena. U komparativnim studijama koncentracije slobodnog i vezanog aflibercepta u kombinaciji s drugim lijekovima bile su slične onima monoterapije, što ukazuje da ove kombinacije (oksaliplatin, cisplatin, fluorouracil, irinotekan, docetaksel, pemetreksed, gemcitabin i erlotinib) ne utječu na farmakokin aflibercepta. Aflibercept, zauzvrat, nije uticao na farmakokinetiku irinotekan-a, fluorouracila, oksaliplatina, cisplatina, docetaksela, pemetrekseda, gemcitabina i erlotiniba.
Datum isteka: 3 godine
Uvjeti ljetovanja u ljekarni: po receptu
Kontraindikacije
- preosjetljivost na aflibercept ili bilo koji od pomoćnih sastojaka lijeka,
- arterijska hipertenzija, nije podložna medicinskoj korekciji,
- hronična srčana insuficijencija III-IV klase (klasifikacija NYHA),
- ozbiljno zatajenje jetre (nedostatak podataka o upotrebi),
- oftalmička upotreba ili unošenje u staklasto tijelo (u vezi sa hiperosmotičkim svojstvima lijeka),
- period dojenja,
- djeca i adolescenti mlađi od 18 godina (zbog nedostatka dovoljnog iskustva u primjeni).
ozbiljno zatajenje bubrega,
- klinički značajne bolesti kardiovaskularnog sistema (koronarna bolest srca, hronična klasa srca I-II prema klasifikaciji NYHA),
- opće stanje> 2 boda na skali za procjenu općeg stanja pacijenta ECOG (Eastern United Group of Oncologists).
Način primjene: doziranje i tijek liječenja
Intravenski u obliku infuzije tokom 1 sata, nakon čega slijedi primjena kemoterapijskog režima FOLFIRI.
Preporučena doza u kombinaciji s kemoterapijskim režimom FOLFIRI iznosi 4 mg / kg tjelesne težine.
Šema hemoterapije FOLFIRI:
prvog dana ciklusa - istodobna intravenska infuzija kroz kateter irinotekan u obliku slova Y u dozi od 180 mg / m2 u trajanju od 90 minuta i kalcijevog folinata (racemi s desne i desne desnice) u dozi od 400 mg / m2 tokom 2 sata, nakon čega slijedi intravenska (bolus ) uvođenje fluorouracila u dozi od 400 mg / m2, nakon čega slijedi kontinuirana intravenska infuzija fluorouracila u dozi od 2400 mg / m2 tokom 46 sati.
Ciklusi hemoterapije se ponavljaju svake 2 sedmice.
Liječenje treba nastaviti dok se ne razvije napredovanje bolesti ili neprihvatljiva toksičnost.
Preporuke za korekciju režima doziranja / odlaganje lečenja
Liječenje treba prekinuti:
- s pojavom jakog krvarenja,
- s razvojem perforacije zidova gastrointestinalnog trakta,
- sa stvaranjem fistule,
- s razvojem hipertenzivne krize ili hipertenzivne encefalopatije,
- s razvojem arterijskih tromboembolijskih komplikacija,
- s razvojem nefrotskog sindroma ili trombotske mikroangiopatije,
- s razvojem teških reakcija preosjetljivosti (uključujući bronhospazam, kratkoću daha, angioedem, anafilaksiju),
- krši zacjeljivanje rana koja zahtijeva medicinsku intervenciju,
- s razvojem sindroma reverzibilne posteriorne encefalopatije (POPs), poznatog i kao reverzibilna posteriorna leukoencefalopatija (POP).
Najmanje 4 tjedna prije zakazane operacije liječenje Zaltrapom treba privremeno obustaviti.
Odgođena hemoterapija Zaltrap / FOLFIRI
Neutropenija ili trombocitopenija: Primjena hemoterapijskog režima Zaltrap / FOLFIRI treba odgoditi sve dok se broj neutrofila u perifernoj krvi ne poveća na> 1500 / μl i / ili se broj trombocita u perifernoj krvi poveća na> 75000 / μl.
Blage ili umjerene reakcije preosjetljivosti (uključujući ispiranje kože, osip, urtikariju i pruritus): Liječenje treba privremeno obustaviti dok reakcija ne prestane. Ako je potrebno, za zaustavljanje reakcije preosjetljivosti moguće je koristiti GCS i / ili antihistaminike.
U sljedećim ciklusima možete razmotriti premedikaciju GCS-a i / ili antihistaminika.
Teške reakcije preosjetljivosti (uključujući bronhospazam, dispneju, angioedem i anafilaksiju): Režim kemoterapije Zaltrap / FOLFIRI treba prekinuti, a terapiju usmjerenu na zaustavljanje reakcije preosjetljivosti treba prekinuti.
Odgoda liječenja Zaltrapom i prilagođavanje doze
Povećanje krvnog pritiska: Trebate privremeno obustaviti upotrebu lijeka dok ne postignete kontrolu nad porastom krvnog pritiska.
Uz opetovani razvoj izrazitog porasta krvnog tlaka, primjena lijeka treba prekinuti dok se ne postigne kontrola nad povišenim krvnim tlakom i u sljedećim ciklusima njegova doza ne smanji na 2 mg / kg tjelesne težine.
Proteinurija: Potrebno je obustaviti upotrebu lijeka za proteinuriju> 2 g / dan, nastavak liječenja moguć je nakon smanjenja proteinurije na 2 g / dan; primjenu Zaltrapa treba prekinuti dok proteinurija ne smanji 20%), barem 2% češće kada se koristi režim kemoterapije Zaltrap / FOLFIRI nego sa FOLFIRI kemoterapijskim režimom (u opadajućem redosledu pojavljivanja): leukopenija, proliv, neutropenija, proteinurija, pojačana aktivnost AKT, stomatitis, umor, trombocitopenija, povećana aktivnost ALT, povišen krvni pritisak, gubitak težine, smanjeni apetit, krvarenje iz nosa, bol u trbuhu, disfonija, povećana kreatinina u serumu i glavobolju.
Sljedeći HP-ovi 3-4 težine najčešće su primijećeni (s učestalošću> 5%), barem 2% češće kada se primjenjuje hemoterapeutski režim Zaltrap / FOLFIRI nego kada se koristi FOLFIRI hemoterapeutski režim (u cilju smanjenja stope incidencije): neutropenija, proliv, povišen krvni pritisak, leukopenija, stomatitis, umor, proteinurija i astenija.
Općenito, prekid terapije zbog pojave štetnih događaja (svih stupnjeva ozbiljnosti) primijećen je u 26,8% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI u usporedbi s 12,1% pacijenata koji su primali režim hemoterapije FOLFIRI.
Najčešći HP-ovi koji su uzrokovali napuštanje terapije u> 1% bolesnika koji su primali režim hemoterapije Zaltrap / FOLFIRI bili su astenija / umor, infekcije, proliv, dehidracija, povišen krvni pritisak, stomatitis, venske tromboembolijske komplikacije, neutropenija i proteinurija.
Prilagođavanje doze (smanjenje doze i / ili propusti) izvedeno je u 16,7%. Odgađanje kasnijih ciklusa terapije veće od 7 dana uočeno je kod 59,7% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI u poređenju sa 42,6% pacijenata koji su primali režim hemoterapije FOLFIRI.
Smrt od drugih uzroka, osim smrti od progresije bolesti, zabilježena u roku od 30 dana nakon posljednjeg ciklusa ispitivanog kemoterapijskog režima, zabilježena je u 2,6% pacijenata koji su primali režim hemoterapije Zaltrap / FOLFIRI i u 1,0% bolesnika koji su primali režim hemoterapije FOLFIRI. Uzrok smrti u bolesnika liječenih Zaltrap / FOLFIRI režimom hemoterapije bila je infekcija (uključujući neutropeničnu sepsu) kod 4 pacijenta, dehidracija u 2 pacijenta, hipovolemija kod 1 pacijenta, metabolička encefalopatija kod 1 pacijenta, bolest respiratornog trakta (akutno zatajenje dišnog sustava, aspiracijska pneumonija) i plućna embolija) kod 3 bolesnika, gastrointestinalne lezije (krvarenje iz čira na dvanaestopalačnom crevu, upala gastrointestinalnog trakta, potpuna opstrukcija creva) kod 3 pacijenta, smrtni ishod iz nepoznatog očigledni razlozi kod 2 pacijenta.
HP-ove i laboratorijske nepravilnosti primijećene u bolesnika liječenih Zaltrap / FOLFIRI režimom hemoterapije (prema MedDRA) predstavljeni su u nastavku. Podaci HP-a definirani su kao bilo koje neželjene kliničke reakcije ili abnormalnosti u laboratorijskim parametrima, čija je učestalost bila> 2% veća (za HP svih stupnjeva ozbiljnosti) u grupi aflibercept u usporedbi s placebo skupinom u istraživanju provedenom na pacijentima s ICP-om. Intenzitet HP-a klasificiran je prema NCI CTC (Nacionalnoj ljestvici ocjene opće otrovnosti Instituta za rak) verzije 3.0.
Određivanje učestalosti HP-a (prema klasifikaciji WHO): vrlo često (> 10%), često (> 1% - 0,1% - 0,01% - 3 stepena ozbiljnosti).
Iz krvi i limfnog sustava: vrlo često - leukopenija (svi stupnjevi težine i> 3 stupnja ozbiljnosti), neutropenija (svi stupnjevi težine i> 3 stupnja ozbiljnosti), trombocitopenija (svi stupnjevi težine), često - febrilna neutropenija svih stupnjeva težine i> 3 stepena ozbiljnosti, trombocitopenija> 3 stepena ozbiljnosti.
Sa imunološkog sistema: često - reakcije preosjetljivosti (svi stupnjevi ozbiljnosti), rijetko - reakcije preosjetljivosti> 3 stupnja ozbiljnosti.
Sa strane metabolizma i ishrane: vrlo često - smanjenje apetita (svi stupnjevi ozbiljnosti), često - dehidracija (svi stupnjevi ozbiljnosti i> 3 stepena ozbiljnosti), gubitak apetita> 3 stepena ozbiljnosti.
Sa strane živčanog sustava: vrlo često - glavobolja (svih stupnjeva ozbiljnosti), često - glavobolja> 3 stupnja ozbiljnosti, rijetko - reverzibilni sindrom posteriorne encefalopatije (SARS).
Od kardiovaskularnog sistema: vrlo često - povišen krvni pritisak (svih stupnjeva ozbiljnosti) (kod 54% pacijenata koji su imali porast krvnog pritiska> 3 stepena ozbiljnosti, porast krvnog pritiska razvijen tokom prva dva ciklusa lečenja), krvarenje / krvarenje (svi stepeni ozbiljnost), od kojih je najčešća vrsta krvarenja manja krvarenja iz nosa (1-2 stepena težine), često arterijske tromboemboličke komplikacije (ATEO) (poput akutnih cerebrovaskularnih nesreća, uključujući prolazne cerebrovaskularne ishemijske napade, angina pektoris, intrakardijalni tromb, infarkt miokarda, arterijska tromboembolija i ishemijski kolitis) (svi stupnjevi ozbiljnosti), venske tromboembolijske komplikacije (VTEO) (tromboza dubokih vena i plućna embolija) svih stepena težine, krvarenje> 3 godine ozbiljnosti, sa težinom od 3 godine, uključujući gastrointestinalno krvarenje, hematuriju, krvarenje nakon medicinskih postupaka, nepoznata učestalost - kod pacijenata koji su primali Zaltrap zabilježen je razvoj teškog intrakranijalnog krvarenja i plućnog krvarenja. ny / hemoptiza, uključujući sa smrtnim ishodom.
Od respiratornog sistema: vrlo često - kratkoća daha (svih stepena ozbiljnosti), krvarenja iz nosa (svih stepena težine), disfonija (svih stepena ozbiljnosti), često - bol u orofarinksu (svih stepena ozbiljnosti), rinoreja (primećena je samo 1-2 rinoreje težina), rijetko - otežano disanje> 3 stepena težine, krvarenje iz nosa> 3 stepena težine, disfonija> 3 stepena ozbiljnosti, bol u orofarinksu> 3 stepena težine.
Od probavnog sistema: vrlo često - proliv (svi stepeni težine i> 3 stepena ozbiljnosti), stomatitis (svi stepeni težine i> 3 stepena težine), bolovi u trbuhu (svi stepeni težine), bolovi u gornjem dijelu trbuha (svi stepeni težine) , često - bolovi u trbuhu> 3 stepena ozbiljnosti, bol u gornjem dijelu trbuha> 3 stupnja ozbiljnosti, hemoroidi (svi stepeni ozbiljnosti), krvarenja iz rektuma (svi stepeni težine), bol u rektumu (svi stepeni težine), zubobolja ( svi stepeni ozbiljnosti), aftozni stomatitis (svi stepeni ozbiljnosti) jedite), formiranje fistula (analne, tanke crevne-mokraćne, spoljašnje tankog creva tankog creva, debelo crevo-vaginalna, interintestinalna) (svih stupnjeva težine), retko - formiranje gastrointestinalnih fistula> 3 stepena težine, perforacija zidova gastrointestinalnog trakta svih stupnjeva i 3 stupnja ozbiljnosti, uključujući fatalne perforacije stijenki gastrointestinalnog trakta, krvarenje iz rektuma> 3 stupnja ozbiljnosti, aftozni stomatitis> 3 stupnja ozbiljnosti, bol u rektumu> 3 stupnja ozbiljnosti.
Od kože i potkožnih tkiva: vrlo često - sindrom paltarno-plantarne eritrodisteze (svi stupnjevi ozbiljnosti), često - hiperpigmentacija kože (svi stupnjevi ozbiljnosti), sindrom paltarno-plantarne eritrodisteze> 3 stepena ozbiljnosti.
Iz mokraćnog sustava: vrlo često - proteinurija (prema kombiniranim kliničkim i laboratorijskim podacima) (svi stupnjevi ozbiljnosti), povećanje koncentracije kreatinina u serumu (svi stupnjevi ozbiljnosti), često - proteinurija> 3 stupnja ozbiljnosti, rijetko - nefrotski sindrom. Jednom bolesniku s proteinurijom i povišenim krvnim pritiskom od 611 pacijenata koji su liječeni režimom hemoterapije Zaltrap / FOLFIRI dijagnosticirana je trombotička mikroangiopatija.
Opće reakcije: vrlo često - astenična stanja (svi stupnjevi ozbiljnosti), osjećaj umora (svi stupnjevi ozbiljnosti i> 3 stupnja ozbiljnosti), često - astenična stanja (> 3 stupnja ozbiljnosti), rijetko - oštećena zarastanja rana (divergencija ivica rane, neuspjeh anastomoza ) (svi stepeni ozbiljnosti i> 3 stepena ozbiljnosti).
Laboratorijski i instrumentalni podaci: vrlo često - povećana aktivnost ACT, ALT (svi stupnjevi ozbiljnosti), smanjena tjelesna težina (svi stupnjevi ozbiljnosti), često - povećana aktivnost ACT, ALT> 3 stupnja težine, gubitak težine> 3 stupnja težine.
Učestalost nuspojava u posebnim grupama pacijenata
U starijih bolesnika (> 65 godina) učestalost dijareje, vrtoglavice, astenije, gubitka težine i dehidratacije bila je više od 5% nego u bolesnika mlađe dobi. Starije pacijente treba pomno nadzirati zbog razvoja dijareje i / ili moguće dehidracije.
U bolesnika s blagim oštećenjem bubrežne funkcije u vrijeme primjene lijeka, učestalost HP-a bila je uporediva s onom u bolesnika bez oštećenja bubrega u vrijeme kad je lijek započet. U bolesnika s umjerenim i teškim oštećenjem bubrega, pojava nerenalnog HP-a općenito je bila usporediva s onom u bolesnika bez zatajenja bubrega, s izuzetkom porasta učestalosti dehidracije (svih stupnjeva ozbiljnosti) za> 10%.
Kao i svi drugi proteinski lijekovi, aflibercept ima potencijalni rizik od imunogenosti. Općenito, prema rezultatima svih onkoloških kliničkih ispitivanja nijedan pacijent nije pokazao visoki titar antitijela na aflibercept.
Nema podataka o sigurnosti uzimanja Zaltrapa u dozama većim od 7 mg / kg jednom svake 2 sedmice ili 9 mg / kg jednom u 3 tjedna. Najčešći HP opaženi s ovim režimima doziranja bili su slični HP-u opaženim tijekom korištenja lijeka u terapijskim dozama.
Ne postoji specifičan protuotrov za lijek.U slučaju predoziranja, pacijentima je potreban potporni tretman, posebno nadgledanje i liječenje arterijske hipertenzije i proteinurije. Pacijenta treba pomno nadzirati radi prepoznavanja i praćenja bilo kojeg HP-a.
Posebna uputstva
Prije početka liječenja i prije početka svakog novog ciklusa liječenja afliberceptom, preporučuje se provođenje općeg ispitivanja krvi s definicijom formule leukocita.
S prvim razvojem neutropenije> 3 stupnja ozbiljnosti treba razmotriti terapijsku upotrebu G-CSF-a, osim toga u bolesnika koji imaju povećan rizik od razvoja neutropeničnih komplikacija, preporučuje se uvođenje G-CSF-a za prevenciju neutropenije.
Pacijente treba neprestano nadzirati zbog znakova i simptoma gastrointestinalnih i drugih jakih krvarenja. Aflibercept se ne smije davati pacijentima sa jakim krvarenjem.
Pacijente treba nadzirati zbog znakova i simptoma perforacije zidova gastrointestinalnog trakta. U slučaju perforacije stijenki gastrointestinalnog trakta, liječenje afliberceptom treba prekinuti.
S razvojem fistula potrebno je prekinuti liječenje afliberceptom.
Tijekom liječenja afliberceptom preporučuje se praćenje krvnog tlaka svaka 2 tjedna, uključujući praćenje krvnog tlaka prije primjene aflibercepta ili češće prema kliničkim indikacijama tijekom liječenja afliberceptom. U slučaju povišenog krvnog pritiska tijekom liječenja afliberceptom, treba primijeniti odgovarajuću antihipertenzivnu terapiju i redovno pratiti krvni tlak. Uz prekomjerni porast krvnog tlaka, liječenje afliberceptom treba prekinuti dok se krvni tlak ne smanji na ciljane vrijednosti, a u kasnijim ciklusima dozu aflibercepta treba smanjiti na 2 mg / kg. U slučaju razvoja hipertenzivne krize ili hipertenzivne encefalopatije, primjenu lijeka aflibercept treba prekinuti.
Treba primjenjivati oprez prilikom primjene Zaltrapa pacijentima s klinički izraženom kardiovaskularnom patologijom, poput koronarne bolesti srca i zatajenja srca. Ne postoje klinička ispitivanja primjene lijekova bolesnicima sa zatajenjem srca funkcionalne klase III i IV prema klasifikaciji NYHA.
Ako pacijent razvije ATEO, liječenje afliberceptom treba prekinuti.
Prije svake primjene aflibercepta, proteinuriju treba utvrditi pomoću test trake ili određivanjem omjera proteina / kreatinina u urinu kako bi se otkrio razvoj ili povećanje proteinurije. Pacijenti s omjerom proteina / kreatinina u urinu> 1 trebali bi odrediti količinu bjelančevina u dnevnoj mokraći.
S razvojem nefrotskog sindroma ili trombotske mikroangiopatije liječenje afliberceptom treba prekinuti.
U slučaju jake reakcije preosjetljivosti (uključujući bronhospazam, kratkoću daha, angioedem i anafilaksiju) liječenje treba prekinuti i započeti odgovarajuću terapiju s ciljem zaustavljanja ovih reakcija.
Ako se razvije blaga reakcija preosjetljivosti na aflibercept (uključujući hiperemiju kože, osip, urtikariju, pruritus), liječenje treba privremeno obustaviti dok se reakcija ne razriješi. Ako je klinički potrebno, za zaustavljanje ovih reakcija mogu se koristiti kortikosteroidi i / ili antihistaminici. U sljedećim ciklusima možete razmotriti premedikaciju GCS-a i / ili antihistaminika. Prilikom nastavljanja liječenja pacijenata koji su prethodno imali reakcije preosjetljivosti, treba biti oprezan, jer kod nekih pacijenata opažen je ponovni razvoj reakcija preosjetljivosti, uprkos njihovoj profilaksi, uključujući upotrebu kortikosteroida.
Primjenu aflibercepta treba prekinuti najmanje 4 tjedna nakon većih kirurških intervencija i sve dok se kirurška rana potpuno ne zacijeli. Za manje kirurške intervencije, poput ugradnje centralnog venskog katetera, biopsije, vađenja zuba, liječenje afliberceptom može se započeti / nastaviti nakon što se kirurška rana potpuno zacijeli.U bolesnika s oštećenim zacjeljivanjem rana koje zahtijevaju medicinsku intervenciju primjena aflibercepta treba prekinuti.
POP se mogu manifestirati promjenom mentalnog stanja, epileptičnim napadima, mučninom, povraćanjem, glavoboljom i poremećajem vida. Dijagnoza LUTS potvrđuje se MRI pretragom mozga. U bolesnika sa POP-om primenu aflibercepta treba prekinuti.
Stariji pacijenti (> 65 godina) imaju povećan rizik od razvoja dijareje, vrtoglavice, astenije, gubitka težine i dehidracije. Da bi se rizik smanjio na minimum, takvim pacijentima potreban je pažljiv medicinski nadzor radi ranog otkrivanja i liječenja znakova i simptoma dijareje i dehidracije.
Pacijenti s indeksom općeg stanja> 2 boda (na skali od 5 do 0 bodova od 0 do 4 točke ECOG-a Istočne zajedničke onkološke grupe) ili koji imaju ozbiljne popratne bolesti mogu imati veći rizik od nepovoljnih kliničkih rezultata i trebaju pažljiv medicinski nadzor za rano otkrivanje kliničkog pogoršanja.
Zaltrap je hiperosmotična otopina, čiji je sastav nespojiv sa unošenjem u intraokularni prostor. Lijek se ne može unijeti u staklasto tijelo.
Nisu provedena ispitivanja o utjecaju Zaltrapa na sposobnost upravljanja vozilima ili drugih potencijalno opasnih aktivnosti. Ako pacijenti razviju simptome koji utječu na njihov vid i sposobnost koncentracije, kao i usporavaju psihomotorne reakcije, bolesnike treba savjetovati da se suzdrže od upravljanja vozilima i drugih potencijalno opasnih aktivnosti.
Trudnoća i dojenje
Nema podataka o upotrebi aflibercepta u trudnica. U eksperimentalnim studijama otkriveni su embriotoksični i teratogeni efekti aflibercepta u životinja. Jer angiogeneza je od velikog značaja za razvoj embrija; inhibicija angiogeneze uz primjenu Zaltrapa može uzrokovati štetne efekte za razvoj trudnoće. Upotreba lijeka tijekom trudnoće je kontraindicirana.
Ženama u rodnoj dobi treba savjetovati da izbjegavaju začeće tijekom liječenja Zaltrapom. Trebaju biti informisani o mogućnosti štetnih učinaka lijeka na plod.
Žene u rodnoj dobi i plodni muškarci trebaju koristiti učinkovite metode kontracepcije za vrijeme liječenja i najmanje 6 mjeseci nakon posljednje doze lijeka.
Postoji vjerojatnost oštećenja plodnosti kod muškaraca i žena tijekom liječenja afliberceptom (na temelju podataka dobivenih u studijama provedenim na majmunima, kod muškaraca i žena kojih je aflibercept izazvao poremećaje plodnosti, potpuno reverzibilne nakon 8-18 tjedana).
Nije bilo kliničkih studija koje bi procijenile učinke Zaltrapa na proizvodnju majčinog mlijeka, izolaciju aflibercepta s majčinim mlijekom i učinak lijeka na dojenčad.
Nije poznato da li se aflibercept sa majčinim mlijekom izlučuje kod žena. Međutim, zbog činjenice da je nemoguće isključiti mogućnost prodora aflibercepta u majčino mlijeko, kao i mogućnost razvoja ozbiljnih nuspojava koje aflibercept može izazvati kod novorođenčadi, potrebno je ili odbiti dojenje ili ne koristiti Zaltrap ( ovisno o važnosti upotrebe lijeka za majku).
Interakcija
Formalna ispitivanja interakcije lijekova sa Zaltrapom nisu provedena.
U komparativnim studijama koncentracije slobodnog i vezanog aflibercepta u kombinaciji s drugim lijekovima bile su slične koncentraciji aflibercepta u monoterapiji, što ukazuje da ove kombinacije (oksaliplatin, cisplatin, fluorouracil, irinotekan, docetaksel, pemetreksed, gemcitabin i erlotinib) ne utječu. farmakokinetika aflibercepta.
Nozološka klasifikacija (ICD-10)
| Koncentrirajte za otopinu za infuziju | 1 ml |
| aktivna supstanca: | |
| aflibercept | 25 mg |
| pomoćne tvari: natrijum dihidrogen fosfat monohidrat - 0,5774 mg, natrijum hidrogen fosfat heptahidrat - 0,2188 mg, limunska kiselina monohidrat - 0,0443 mg, natrijum citrat dihidrat - 1,4088 mg, natrijum hlorid - 5,84 mg, 0,1 M hlorovodonična rastvora kiselina ili 0,1 M rastvor natrijum hidroksida - do pH 5,9-6,5, saharoza - 200 mg, polisorbat 20 - 1 mg, voda za injekcije - do 1 ml |
Farmakodinamika
Aflibercept je rekombinantni fuzijski protein koji se sastoji od vezivanja za VEGF (vaskularni endotelni faktor rastaendotelni vaskularni faktori rasta) dijelovi izvanćelijskih domena receptora VEGF-1 i VEGF-2 spojena na Fc domenu (fragment sposoban za kristalizaciju) IgG1 osoba.
Aflibercept se proizvodi upotrebom rekombinantne DNK tehnologije korišćenjem K-1 sistema za izradu ćelija jajnika kineskog hrčka (CHO).
Aflibercept je himerni glikoprotein molekulske mase 97 kDa, glikozilacija proteina dodaje 15% ukupnoj molekulskoj masi, što rezultira ukupnom molekulskom masom aflibercepta od 115 kDa.
Endotelni vaskularni faktor rasta A (VEGF-A), endotelni vaskularni faktor rasta B (VEGF-B) i faktor rasta placente (PLGF) se odnose na VEGF- porodica angiogenih faktora koji mogu djelovati kao jaki mitogeni, hemotaktički i vaskularni faktori propusnosti za endotelne stanice. Akcija VEGF-A provode se kroz dvije receptorske tirozin kinaze - VEGFR-1 i VEGFR-2 smještena na površini endotelnih ćelija. Plgf i VEGF-B vezuju se samo za tirozin kinazu receptora VEGFR-1, koji se osim na površini endotelnih ćelija, nalazi i na površini leukocita. Pretjerana aktivacija ovih receptora VEGF-A može dovesti do patološke neovaskularizacije i povećane vaskularne propustljivosti. Plgf važan i za razvoj patološke neovaskularizacije i infiltracije tumora od strane upalnih ćelija.
Aflibercept djeluje kao rastvorljivi receptor za zamku na koji se veže VEGF-A s većim afinitetom od nativnih receptora VEGF-Aosim ovoga, on se veže i za srodne ligande VEGF-B i Plgf. Aflibercept je povezan s ljudskim VEGF-A, VEGF-B i Plgf s stvaranjem stabilnih inertnih kompleksa koji nemaju biološku aktivnost. Djelujući kao zamka za ligande, aflibercept sprečava vezanje endogenih liganda na njihove odgovarajuće receptore i tako blokira prijenos signala putem tih receptora.
Aflibercept blokira aktivaciju receptora VEGF i proliferacija endotelnih ćelija čime se inhibira stvaranje novih posuda koje opskrbljuju tumor kisikom i hranjivim tvarima.
Aflibercept je povezan s VEGF-A ljudska (ravnotežna konstanta disocijacije (Cd) - 0,5 pmola za VEGF-A165 i 0,36 pmol za VEGF-A121), s Plgf osoba (cd 39 pmol za Plgf-2), s VEGF-B humanog (Cd 1,92 pmol) s stvaranjem stabilnog inertnog kompleksa koji nema biološku aktivnost koja je moguće utvrditi.
Upotreba aflibercepta kod miševa s ksenograftom ili alograft tumorima inhibirala je rast različitih vrsta adenokarcinova.
U bolesnika s metastatskim kolorektalnim karcinomom (MKRP) koji su prethodno liječeni hemoterapijom koja sadrži oksaliplatin (sa ili bez prethodne primjene bevacizumaba), režim kemoterapije Zaltrap ® /FOLFIRI (fluorouracil, irinotekan, kalcijev folinat) pokazao je statistički značajno povećanje životnog vijeka u odnosu na kemoterapijski režim FOLFIRI.
Farmakokinetika
Apsorpcija U pretkliničkim studijama provedenim na tumorskim modelima, biološki aktivne doze aflibercepta korelirane su s dozama potrebnim za stvaranje koncentracija slobodnog aflibercepta koji cirkulira u sistemskom cirkulaciji, prelazeći koncentracije aflibercepta koji cirkuliraju u sistemskom krvotoku povezane s VEGF. Koncentracije koje kruže u sistemskom cirkulaciji povezane s VEGF aflibercepta povećanjem doze povećava se do većine VEGF nije povezan.Daljnje povećanje doze aflibercepta dovodi do povećanja koncentracije slobodnog aflibercepta koji cirkulira u sistemskoj cirkulaciji i samo do neznatnog daljnjeg povećanja koncentracije povezane s VEGF aflibercepta.
U bolesnika se Zaltrap ® primjenjuje u dozi od 4 mg / kg iv svaka 2 tjedna, tijekom kojih postoji višak koncentracije slobodnog aflibercepta koji cirkulira nad koncentracijom aflibercepta povezanog sa VEGF.
U preporučenoj dozi od 4 mg / kg jednom u 2 tjedna, koncentracija slobodnog aflibercepta je blizu vrijednosti Css postignuti tokom drugog ciklusa liječenja, bez ikakvog nakupljanja (koeficijent akumulacije 1,2 u ravnoteži, u usporedbi s koncentracijom slobodnog aflibercepta pri prvoj injekciji).
Distribucija. Vss besplatna aflibercepta je 8 litara.
Metabolizam Budući da je aflibercept protein, ispitivanja njegovog metabolizma nisu provedena. Očekuje se da će se aflibercept razgraditi na male peptide i pojedine aminokiseline.
Eliminacija. Slobodni aflibercept koji cirkulira u sistemskoj cirkulaciji uglavnom je povezan sa VEGF-družina sa stvaranjem stabilnih neaktivnih kompleksa. Očekuje se da, kao i drugi veliki proteini povezani sa VEGF i slobodni aflibercept će se postupno eliminirati iz sistemske cirkulacije putem drugih bioloških mehanizama, poput proteolitičkog katabolizma.
Pri dozama većim od 2 mg / kg, klirens slobodnog aflibercepta iznosio je 1 l / dan sa konačnim T1/2 6 dana
Proteini velike molekularne mase ne izlučuju se bubrezima, pa se očekuje da će bubrežna ekskrecija aflibercepta biti minimalna.
Linearnost / nelinearnost eliminacije. U vezi s ciljanim vezivanjem aflibercepta na njegov cilj (endogeno VEGF) slobodni aflibercept u dozama ispod 2 mg / kg pokazao je brzi (nelinearni) pad koncentracija u sistemskoj cirkulaciji, očigledno povezan s njegovim visokim afinitetom koji se veže na endogeni VEGF. U rasponu doza od 2 do 9 mg / kg, očistenje slobodnog aflibercepta postaje linearno, očigledno zbog nezasićenih mehanizama izlučivanja biologije, kao što je katabolizam proteina.
Posebne grupe pacijenata
Deca. Sa uključenjem / uvođenjem lijeka Zaltrap ® u dozama od 2, 2,5, 3 mg / kg svaka 2 tjedna. 8 pedijatrijskih bolesnika s solidnim tumorima (u dobi od 5 do 17 godina), prosječna T1/2 slobodni aflibercept, utvrđen nakon prve doze, bio je otprilike 4 dana (3 do 6 dana).
Stariji pacijenti. Starost ne utječe na farmakokinetiku aflibercepta.
Pol Uprkos razlikama u razmaku slobodnog aflibercepta i Vd kod muškaraca i žena nisu primijećene razlike u spolu u njenoj sistemskoj izloženosti kada je primijenjen u dozi od 4 mg / kg.
Indeks tjelesne mase Tjelesna masa utjecala je na čišćenje slobodnog aflibercepta i Vd Dakle, kod pacijenata s tjelesnom težinom većom od 100 kg, opaženo je povećanje sistemske izloženosti afliberceptu za 29%.
Rasna pripadnost Rasna i etnička pripadnost nisu utjecala na farmakokinetiku aflibercepta.
Zatajenje jetre. Formalna ispitivanja primjene Zaltrap® u bolesnika s zatajenjem jetre nisu provedena.
U bolesnika s blagom (ukupna koncentracija bilirubina u krvi ≤1,5 VGN u bilo kojoj vrijednosti ACT aktivnosti) i srednjom (ukupna koncentracija bilirubina u krvi> 1,5-3 VGN pri bilo kojoj vrijednosti ACT aktivnosti), zatajenje jetre nije otkrilo promjenu klirensa aflibercept . Nema podataka o farmakokinetici aflibercepta u bolesnika s teškim oštećenjem jetre (koncentracija ukupnog bilirubina u krvi> 3 VGN pri bilo kojoj vrijednosti ACT aktivnosti).
Zatajenje bubrega. Formalna ispitivanja primjene Zaltrap® u bolesnika s bubrežnim zatajenjem nisu provedena.
Nisu utvrđene razlike u sistemskoj izloženosti (AUC) slobodnom afliberceptu kod pacijenata s bubrežnim zatajenjem različitog stupnja ozbiljnosti kada se koristi Zaltrap ® u dozi od 4 mg / kg.
Trudnoća i dojenje
Nema podataka o upotrebi aflibercepta u trudnica. Ispitivanja na životinjama otkrila su embriotoksične i teratogene efekte kod aflibercepta. Budući da je angiogeneza od velikog značaja za razvoj embrija, inhibicija angiogeneze uz primjenu Zaltrapa ® može dovesti do štetnih učinaka na razvoj trudnoće. Primjena Zaltrap ® tijekom trudnoće i kod žena koje su možda trudne ne preporučuje se.
Ženama u rodnoj dobi treba savjetovati da izbjegavaju trudnoću tijekom liječenja Zaltrapom ®, te ih treba obavijestiti o mogućnosti štetnih učinaka Zaltrapa ® na fetus.
Žene u rodnoj dobi i plodni muškarci trebali bi koristiti učinkovite metode kontracepcije za vrijeme liječenja i najmanje 6 mjeseci nakon posljednje doze liječenja.
Postoji mogućnost oslabljene plodnosti kod muškaraca i žena tijekom liječenja afliberceptom (na temelju podataka dobivenih u studijama provedenim na majmunima, kod muškaraca i žena kojih je aflibercept uzrokovao oštećenu plodnost, koja je u potpunosti reverzibilna nakon 8-18 tjedana).
Kliničke studije za procjenu učinka Zaltrap ® na proizvodnju majčinog mlijeka, oslobađanje aflibercepta u majčinom mlijeku i njegov utjecaj na novorođenčad nisu provedene.
Nije poznato da li se aflibercept izlučuje u majčino mlijeko. Međutim, zbog činjenice da je nemoguće isključiti mogućnost prodora aflibercepta u majčino mlijeko, kao i mogućnost razvoja ozbiljnih nuspojava uzrokovanih afliberceptom kod dojenčadi, potrebno je ili odbiti dojenje ili ne koristiti Zaltrap ® (ovisno o tome važnost upotrebe lijeka za majku).
Nuspojave
Najčešće nuspojave (HP) (svih stupnjeva ozbiljnosti, s učestalošću od ≥20%), koje se primjećuju najmanje 2% češće kod primjene režima hemoterapije Zaltrap ® /FOLFIRInego sa režimom hemoterapije FOLFIRIbili su sljedeći HP (prema smanjenju incidencije): leukopenija, proliv, neutropenija, proteinurija, povećana aktivnost ACT, stomatitis, umor, trombocitopenija, pojačana ALT aktivnost, povišen krvni pritisak, smanjena tjelesna težina, smanjen apetit, krvarenje iz nosa, bolovi u trbuhu i sl. disfonija, povećana koncentracija kreatinina u serumu i glavobolja.
Najčešći HP težine 3-4 stepena (s učestalošću ≥5%), koji se primjećuje najmanje 2% češće kod primjene režima hemoterapije Zaltrap ® /FOLFIRI u odnosu na režim hemoterapije FOLFIRIbili su sledeći HP (u opadajućem redosledu pojavljivanja): neutropenija, proliv, povišen krvni pritisak, leukopenija, stomatitis, umor, proteinurija i astenija.
Općenito, prekid terapije zbog pojave štetnih događaja (svih stupnjeva ozbiljnosti) primijećen je u 26,8% pacijenata koji su primili režim hemoterapije Zaltrap ® /FOLFIRI, u odnosu na 12,1% pacijenata koji su primali režije hemoterapije FOLFIRI. Najčešći HP, koji je poslužio kao razlog za odbijanje terapije u ≥1% pacijenata koji su primili režim hemoterapije Zaltrap ® /FOLFIRIbili su: astenija / umor, infekcije, proliv, dehidracija, povišen krvni pritisak, stomatitis, venske tromboembolijske komplikacije, neutropenija i proteinurija.
Prilagođavanje doze lijeka Zaltrap ® (smanjenje doze i / ili propusti) provedeno je u 16,7%. Odgađanje kasnijih ciklusa terapije duže od 7 dana uočeno je kod 59,7% pacijenata koji su primili režim hemoterapije Zaltrap ® /FOLFIRIu usporedbi sa 42,6% pacijenata koji su primali režim hemoterapije FOLFIRI.
Smrt od drugih uzroka, pored progresije bolesti, zabilježene u roku od 30 dana nakon posljednjeg ciklusa ispitivanog kemoterapijskog režima, zabilježena je u 2,6% pacijenata koji su primili režim hemoterapije Zaltrap ® /FOLFIRI, a kod 1% pacijenata koji su primali režim hemoterapije FOLFIRI. Uzrok smrti pacijenata koji su primali režim hemoterapije Zaltra ® /FOLFIRIbile su: infekcija (uključujući neutropeničnu sepsu) kod 4 pacijenta, dehidracija u 2 pacijenta, hipovolemija kod 1 pacijenta, metabolička encefalopatija kod 1 pacijenta, bolest respiratornog trakta (akutno respiratorno zatajenje, aspiraciona pneumonija i plućna embolija) kod 3 pacijenti, poremećaji gastrointestinalnog trakta (krvarenje iz dvanaestopalačnog čira, upala gastrointestinalnog trakta, potpuna opstrukcija creva) kod 3 pacijenta, smrt od nepoznatih uzroka kod 2 pacijenta.
Ispod su HP i abnormalnosti laboratorijskih parametara primijećene kod pacijenata koji su primili režim hemoterapije Zaltrap ® /FOLFIRI njihovom podjelom na klase organskih organa u skladu s klasifikacijom Medicinskog rječnika za regulatorne aktivnosti MedDRA.
Niže predstavljeni HP-ovi definirani su kao bilo koje neželjene kliničke reakcije ili abnormalnosti u laboratorijskim parametrima s ≥2% većom učestalošću (za HP svih stupnjeva ozbiljnosti) u grupi aflibercept u usporedbi s placebo skupinom u istraživanju provedenom na pacijentima s ICP-om. Intenzitet HP-a je klasifikovan prema NCI CTC (Opći terminološki kriterijumi Instituta za rakNacionalna ljestvica ocjene opće toksičnosti Nacionalnog instituta za rak) verzija 3.0.
Incidencija HP-a određena je u skladu sa SZO klasifikacijom kako slijedi: vrlo često - ≥10%, često - ≥1– uklj. ≥3 ozbiljnosti).
Sa dela krvi i limfnog sistema: vrlo često - leukopenija (svih stupnjeva ozbiljnosti, uključujući ≥3. stupanj ozbiljnosti), neutropenija (svih stepena ozbiljnosti, uključujući i treći stupanj ozbiljnosti), trombocitopenija (svi stepeni težine), često - febrilna neutropenija (svih stupnjeva ozbiljnosti, uključujući ≥3 stepen ozbiljnosti), trombocitopenija (≥3 stepen ozbiljnosti).
Iz imunog sistema: često - reakcije preosjetljivosti (svi stupnjevi ozbiljnosti), rijetko - reakcije preosjetljivosti (≥3. ozbiljnost).
Metabolički i nutritivni poremećaji: vrlo često - smanjenje apetita (svi stupnjevi ozbiljnosti), često - dehidratacija (svi stepeni težine i ≥3 stepena ozbiljnosti), smanjenje apetita (≥3 stupnja ozbiljnosti).
Iz nervnog sistema: vrlo često - glavobolja (svih stepena težine), često - glavobolja (≥3 stepena ozbiljnosti), ređe - POPs.
Sa plovila: vrlo često - porast krvnog pritiska (svih stupnjeva ozbiljnosti) (kod 54% pacijenata koji su imali porast krvnog pritiska (≥3 stepena ozbiljnosti), porast krvnog pritiska razvijena tokom prva dva ciklusa liječenja), krvarenje / krvarenje (svih stepena težine), najčešća vrsta krvarenja bila su manja krvarenja iz nosa (1-2 težine), često arterijske tromboemboličke komplikacije (ATEO) (poput akutnih cerebrovaskularnih nesreća, uključujući prolazne cerebrovaskularne ishemijske napade, anginu pektoris, intrakardijalni t ombus, infarkt miokarda, arterijska tromboembolija i ishemijski kolitis) (svi stupnjevi ozbiljnosti), venske tromboembolijske komplikacije (duboka venska tromboza i plućna embolija) svih stupnjeva težine, krvarenje (≥3 stepena ozbiljnosti, ponekad fatalno), uključujući gastrointestinalni - crijevna krvarenja, hematurija, krvarenje nakon medicinskih postupaka, učestalost nije poznata - kod pacijenata koji su primali Zaltrap ®, zabilježen je razvoj teškog intrakranijalnog krvarenja i plućne krvarenja / hemoptize, tj. . kobno.
Iz respiratornog sistema, grudnog koša i medijastinalnih organa: vrlo često - kratkoća daha (svih stepena težine), krvarenje iz nosa (svih stepena težine), disfonija (svih stepena ozbiljnosti), često - bol u orofarinksu (svi stepeni težine), rinoreja (primećena je rinoreja od samo 1-2 ozbiljnosti) , retko - kratkoća daha (≥3 stepen ozbiljnosti), krvarenje iz nosa (≥3 stepena ozbiljnosti), disfonija (≥3 stepena ozbiljnosti), bol u orofarinksu (≥3 stepen ozbiljnosti).
Iz gastrointestinalnog trakta: vrlo često - proliv (svih stepena ozbiljnosti, uključujući ≥3. stupanj ozbiljnosti), stomatitis (svih stepena ozbiljnosti, uključujući i treći stupanj ozbiljnosti), bolovi u trbuhu (svi stepeni težine), bol u gornji deo trbuha (svi stepeni ozbiljnosti), često - bolovi u trbuhu ≥3 stepena ozbiljnosti, bol u gornjem dijelu trbuha (≥3 stepena ozbiljnosti), hemoroidi (svi stepeni težine), krvarenja iz rektuma (svi stepeni težine) , bol u rektumu (svi stepeni težine), zubobolja (svi stepeni ozbiljnosti), aftozni stomatitisi (svi stepeni težine), slike fistule (analne, tanko crijevno-mokraćne, vanjske tanke crijeve (tanko crijevo-koža), velike crijevno-vaginalne, inter-intestinalne) (svih stupnjeva težine), rijetko - formiranje gastrointestinalnih fistula (≥3 stupnja ozbiljnosti), perforacija zidova gastrointestinalnog trakta (svi stupanj ozbiljnosti, uključujući ≥3 stupanj ozbiljnosti), uključujući fatalnu perforaciju zidova gastrointestinalnog trakta, krvarenje iz rektuma (≥3 stupnja ozbiljnosti), aftozni stomatitis (≥3 stepen ozbiljnosti), bol u rektumu ( ≥3 ozbiljnosti).
Na dijelu kože i potkožnog tkiva: vrlo često - palmarno-plantarni sindrom eritrodisteze (svi stupnjevi ozbiljnosti), često - hiperpigmentacija kože (svi stupnjevi ozbiljnosti), palmarno-plantarni sindrom eritrodisteze (težina 3. stupnja).
Iz bubrega i mokraćnih putova: vrlo često - proteinurija (prema kombiniranim kliničkim i laboratorijskim podacima) (svi stupnjevi ozbiljnosti), povećanje koncentracije kreatinina u serumu (svi stupnjevi ozbiljnosti), često - proteinurija (≥3 stupnja ozbiljnosti), rijetko - nefrotski sindrom. Jedan pacijent s proteinurijom i povišenim krvnim pritiskom od 611 pacijenata liječenih režimom hemoterapije Zaltrap ® /FOLFIRI, dijagnosticirana je trombotička mikroangiopatija.
Opći poremećaji i reakcije na mjestu ubrizgavanja: vrlo često - astenična stanja (svi stepeni ozbiljnosti), osećaj umora (svi stepeni težine, uključujući ≥3 stepena ozbiljnosti), često - astenična stanja (≥3 stepena ozbiljnosti), retko - oštećena zarastanja rana ( odstupanje rubova rane, neuspjeh anastomoza) (svi stupnjevi težine, uključujući ≥3 stupnja težine).
Laboratorijski i instrumentalni podaci: vrlo često - povećana aktivnost ACT, ALT (svi stupnjevi ozbiljnosti), smanjena tjelesna masa (svi stupnjevi ozbiljnosti), često - povećana aktivnost ACT, ALT (≥3. stupanj ozbiljnosti), smanjena tjelesna težina (≥3. stupanj ozbiljnosti) .
HP učestalost u posebnim grupama pacijenata
Starost. U starijih bolesnika (≥ 65 godina) učestalost dijareje, vrtoglavice, astenije, gubitka tjelesne težine i dehidracije bila je veća za 5% nego u bolesnika mlađe dobi. Starije pacijente treba pomno nadzirati zbog razvoja dijareje i / ili moguće dehidracije.
Zatajenje bubrega. U bolesnika s blagim oštećenjem bubrega u vrijeme početka primjene Zaltrapa ®, incidencija HP-a bila je usporediva s onom u bolesnika bez oštećenja bubrežne funkcije u vrijeme početka primjene Zaltrap®-a. U bolesnika s umjerenim i teškim oštećenjem bubrega, pojava ne-bubrežnog HP-a općenito je bila usporediva s onom u bolesnika bez zatajenja bubrega, s izuzetkom> 10% viška stope dehidracije (svi stupnjevi ozbiljnosti).
Imunogenost Kao i svi drugi proteinski lijekovi, aflibercept ima potencijalni rizik od imunogenosti.Općenito, prema rezultatima svih onkoloških kliničkih ispitivanja nijedan pacijent nije pokazao visoki titar antitijela na aflibercept.
Post-marketinška upotreba lijeka
Od srca: nepoznata frekvencija - zatajenje srca, smanjena frakcija izbacivanja lijeve komore.
Sa strane mišićno-koštanog i vezivnog tkiva: frekvencija nepoznata - osteonekroza čeljusti. U bolesnika koji uzimaju aflibercept prijavljeni su slučajevi osteonekroze čeljusti, posebno kod onih pacijenata koji imaju određene faktore rizika za osteonekrozu čeljusti, poput upotrebe bisfosfonata i / ili invazivnih stomatoloških postupaka.
Doziranje i primjena
Iv, u obliku jednočasovne infuzije praćene uvođenjem kemoterapijskog režima FOLFIRI. Preporučena doza Zaltrap®, koja se koristi u kombinaciji sa hemoterapijskim režimom FOLFIRIje 4 mg / kg.
Režim hemoterapije FOLFIRI
Prvog dana ciklusa - istodobna iv infuzija kroz kateter irinotekan u obliku slova Y u dozi od 180 mg / m2 tokom 90 minuta i kalcijevog folinata (trkači s desne i desne desnice) u dozi od 400 mg / m 2 tokom 2 sata, s naknadna iv (bolusna) primjena fluorouracila u dozi od 400 mg / m 2, praćena kontinuiranom intravenskom infuzijom fluorouracila u dozi od 2400 mg / m 2 tokom 46 sati
Ciklusi hemoterapije se ponavljaju svake 2 sedmice.
Liječenje Zaltrapom ® treba nastaviti sve do napredovanja bolesti ili razvoja neprihvatljive toksičnosti.
Preporuke za korekciju režima doziranja / odlaganje lečenja
Liječenje Zaltrapom ® treba prekinuti u sljedećim slučajevima:
- razvoj jakog krvarenja,
- razvoj perforacije stijenki gastrointestinalnog trakta,
- razvoj hipertenzivne krize ili hipertenzivne encefalopatije,
- razvoj arterijskih tromboembolijskih komplikacija,
- razvoj nefrotskog sindroma ili trombotske mikroangiopatije,
- razvoj teških reakcija preosjetljivosti (uključujući bronhospazam, kratkoću daha, angioedem, anafilaksiju),
- kršenje zarastanja rana, koja zahtijeva medicinsku intervenciju,
- razvoj sindroma reverzibilne posteriorne encefalopatije (POPs), poznatog i kao reverzibilna posteriorna leukoencefalopatija (POP).
Najmanje 4 tjedna prije zakazane operacije liječenje Zaltrapom ® treba privremeno obustaviti.
| Odgođena hemoterapija Zaltrap ® / FOLFIRI | |
| Neutropenija ili trombocitopenija | Primjena režima hemoterapije Zaltrap ® /FOLFIRI treba odgoditi sve dok se broj neutrofila u perifernoj krvi ne poveća na ≥1,5 · 10 9 / l i / ili ako se broj trombocita u perifernoj krvi ne poveća na ≥75 · 10 9 / l |
| Blage ili umjerene reakcije preosjetljivosti (uključujući ispiranje kože, osip, urtikariju i svrbež) | Liječenje treba privremeno obustaviti dok reakcija ne prestane. Ako je potrebno, za zaustavljanje reakcije preosjetljivosti moguće je koristiti GCS i / ili antihistaminike. U sljedećim ciklusima možete razmotriti premedikaciju GCS-a i / ili antihistaminika |
| Teške reakcije preosjetljivosti (uključujući bronhospazam, dispneju, angioedem i anafilaksiju) | Režim kemoterapije Zaltrap ® / treba prekinutiFOLFIRI i provoditi terapiju s ciljem zaustavljanja reakcije preosjetljivosti |
| Odgoda liječenja Zaltrapom ® i prilagođavanje doze | |
| Povećanje krvnog pritiska | Potrebno je privremeno obustaviti upotrebu lijeka Zaltrap ® dok se ne postigne kontrola povećanja krvnog tlaka. Uz opetovani razvoj izrazitog porasta krvnog tlaka, primjena lijeka treba prekinuti dok se ne postigne kontrola porasta krvnog tlaka i, u sljedećim ciklusima, smanjiti dozu Zaltrap ® na 2 mg / kg |
| Proteinurija (vidi „Posebna uputstva“) | Obustaviti upotrebu Zaltrap ® za proteinuriju ≥2 g / dan, liječenje se može nastaviti nakon što proteinurija smanji na ® dok se proteinurija ® ne smanji |
| Teški stomatitis i sindrom palmar-plantarne eritrodisteze | Dozu bolusa i infuzije fluorouracila treba smanjiti za 20% |
| Teška dijareja | Dozu irinotekan-a treba smanjiti za 15–20%. Ako se jaka dijareja razvija više puta, sljedeći ciklus bi trebao dodatno smanjiti bolusnu i infuzionu dozu fluorouracila za 20%. Ako nastane jaka dijareja smanjenim dozama oba lijeka, prekinuti upotrebu FOLFIRI. Ako je potrebno, može se provesti liječenje antidijarejskim lijekovima i nadoknada gubitka tekućine i elektrolita. |
| Febrilna neutropenija i neutropenična sepsa | U narednim ciklusima, dozu irinotekana trebalo bi smanjiti za 15–20%. Uz ponovljeni razvoj u sljedećim ciklusima, bolusnu i infuzijsku dozu fluorouracila potrebno je dodatno smanjiti za 20%. Može se razmotriti primjena G-CSF-a. |
Za više informacija o toksičnosti irinotekan-a, fluorouracila i kalcijevog folinata pogledajte upute za njihovu upotrebu.
Posebne grupe pacijenata
Deca. Sigurnost i efikasnost u pedijatrijskih bolesnika nisu utvrđene.
U studiji sigurnosti i tolerancije s povećanjem doze, 21 pacijent u dobi od 2 do 21 godine (prosječna dob 12,9 godina) s čvrstim tumorima primao je Zaltrap ® u dozama od 2 do 3 mg / kg iv svaka 2 tjedna. Farmakokinetički parametri slobodnog aflibercepta procijenjeni su u 8 ovih bolesnika (u dobi od 5 do 17 godina), vidi Farmakokinetika, pododjeljak "Posebne grupe pacijenata". Maksimalna tolerirana doza u ispitivanju bila je doza od 2,5 mg / kg, što je bila niža od sigurne i efikasne doze za odrasle koji imaju metastatski kolorektalni karcinom.
Stariji pacijenti. Stariji pacijenti ne trebaju prilagođavanje doze Zaltrap ®.
Zatajenje jetre. Formalna ispitivanja primjene Zaltrap® u bolesnika s zatajenjem jetre nisu provedena. Na osnovu kliničkih podataka, sistemska izloženost aflibercepta u bolesnika s blagim do umjerenim zatajenjem jetre bila je slična onoj u bolesnika s normalnom funkcijom jetre.
Klinički dokazi upućuju na to da prilagođavanje doze aflibercepta u bolesnika s blagom do umjerenom insuficijencijom jetre nije potrebno.
Nema podataka o upotrebi aflibercepta u bolesnika s teškim oštećenjem jetre.
Zatajenje bubrega. Formalna ispitivanja primjene Zaltrap® u bolesnika s oštećenom funkcijom bubrega nisu provedena. Na osnovu kliničkih podataka, sistemska izloženost aflibercepta u bolesnika s blagim do umjerenim bubrežnim zatajenjem bila je slična onoj u bolesnika s normalnom bubrežnom funkcijom.
Klinički dokazi upućuju na to da korekcija početne doze aflibercepta u bolesnika s blagim do umjerenim zatajenjem bubrega nije potrebna. Postoji vrlo malo podataka o upotrebi lijeka kod pacijenata s ozbiljnim zatajenjem bubrega, tako da kod takvih bolesnika lijek treba biti oprezan.
Preporuke za pripremu rešenja i njihovo uvođenje
Lijek treba koristiti pod nadzorom liječnika koji ima iskustvo primjene antitumorskih lijekova.
Ne ubrizgavajte nerazređeni koncentrat. Ne ubrizgavajte iv u mlaznicu (ni brzo ni sporo).
Lijek Zaltrap ® nije namijenjen za unošenje u staklast organizam.
Kao i kod svih parenteralnih pripravaka, i prije primjene, razrijeđenu otopinu Zaltrap® treba vizualno pregledati na prisustvo neotopljenih čestica ili promjene boje.
Razređene rastvore Zaltrap® treba davati primjenom IV infuzijskih setova izrađenih od PVC-a koji sadrži dietilheksil ftalat (DEHP), PVC-a koji ne sadrži DEHP, ali sadrži trioktiltrimelalat (TOTM), polipropilen, PE, presvučen unutar PVC-a, poliuretan.
IV infuzijski setovi trebaju sadržavati polietersulfonske filtere s promjerom pora 0,2 mikrona. Ne koristite poliviniliden fluorid (PVDF) ili najlonske filtere.
Zbog nedostatka studija kompatibilnosti, Zaltrap ® se ne smije miješati sa drugim lijekovima ili otapalima, s izuzetkom 0,9% otopine natrijum-hlorida i 5% otopine dekstroze.
Priprema infuzijske otopine i rukovanje
Infuzijsku otopinu lijeka Zaltrap ® treba pripremiti medicinski stručnjak u aseptičnim uvjetima u skladu sa postupcima sigurnog rukovanja.
Ne koristite bočicu s lijekom ako otopina koncentrata sadrži neraztopljene čestice ili je došlo do promjene njegove boje.
Treba koristiti infuzijske posude izrađene od PVC-a koji sadrže DEHP ili poliolefin (bez PVC-a i DEHF-a).
Samo za intravensku infuziju zbog hiperosmolarnosti (1000 momola / kg) Zaltrap® koncentrata.
Lijek nije namijenjen injekciji u staklasto tijelo.
Koncentrat lijeka Zaltrap ® mora se razrijediti. Uklonite potrebnu količinu koncentrata Zaltrap® i razrijedite do potrebne količine sa 0,9% rastvorom natrijum hlorida za injekcije ili 5% rastvorom dekstroze za injekciju.
Koncentracija aflibercepta u infuzijskoj otopini nakon razrjeđivanja koncentrata Zaltrap® treba biti u rasponu od 0,6–8 mg / ml.
S mikrobiološkog stajališta razrijeđenu otopinu Zaltrap® treba odmah upotrijebiti, njegova fizička i kemijska stabilnost održava se do 24 sata pri temperaturi od 2-8 ° C i do 8 sati pri temperaturi od 25 ° C.
Bočice lijeka Zaltrap ® namijenjene su za jednokratnu upotrebu. Svaka količina neiskorištenog lijeka koja ostane u bočici mora se zbrinuti u skladu s relevantnim ruskim zahtjevima. Nemojte ponovo probijati čep za bočicu nakon što je igla već ubačena u nju.
Predoziranje
Nema podataka o sigurnosti uzimanja Zaltrap ® u dozama većim od 7 mg / kg jednom svake 2 sedmice ili 9 mg / kg jednom u 3 tjedna.
Simptomi najčešći HP opaženi s ovim režimima doziranja bili su slični HP-u opaženim s lijekom u terapijskim dozama.
Liječenje: potrebna je terapija održavanja, posebno praćenje i liječenje povišenog krvnog tlaka i proteinurije. Ne postoji specifičan protuotrov za Zaltrap ®. Pacijent bi trebao biti pod budnim medicinskim nadzorom kako bi se identificirao i nadgledao bilo koji HP opisan u odjeljku „Nuspojave“.
Obrazac za puštanje
Koncentrat za otopinu za infuziju, 25 mg / ml. 4 ml lijeka u bočici bezbojnog stakla (tip I), začepljenoj bromobutil gumenim čepom sa aluminijumskim prekrivačem sa zaptivkom i brtvenim diskom. 1 ili 3 sp. u paketu od kartona. 8 ml lijeka u bočici bezbojnog stakla (tip I), začepljeno čepom od bromobutilne gume sa aluminijumskim prekrivačem sa zapornim prstenom i zaptivnim diskom. 1 sp. u paketu od kartona.
Upute za upotrebu Zaltrap
Aktivna supstanca: aflibercept 25 mg
Pomoćni sastojci: natrijum-fosfat monohidrat (E339), natrijum hidrogenfosfat heptahidrat (E339), limunska kiselina monohidrat (E330), natrijum-citrat-dihidrat (E331), granulirani natrijum-hlorid, saharoza, polisorbat 20 (E433), hlorovodonična kiselina 36% (E507), natrijum hidroksid (E524), voda za ubrizgavanje.
Opis Prozirna bezbojna ili blijedo žuta tekućina, bez mehaničkih nečistoća.
Opis lijeka

Lijek spada u grupu antitumorskih sredstava. Proizvodi se u obliku koncentrata iz kojeg se pripravljaju otopine za infuziju. Međunarodno vlasničko ime je aflibercept. Trgovački nazivi su Zaltrap i Eilea.
Indikacije za upotrebu
Istovremeno se uzima određena doza folinske kiseline, irinotekan i fluorouracil. Sve ove komponente koriste se za hemoterapiju kod pacijenata koji pate od kolorektalnog karcinoma, kada pokazuje visoku otpornost na druga antitumorska sredstva. Takođe, "Zaltrap" se koristi za povraćanje.

Farmakološko djelovanje aflibercepta
Pod utjecajem aflibercepta prestaju djelovati receptori koji osiguravaju stvaranje novih krvnih žila radi prehrane i pojačavaju rast tumora. Zbog činjenice da ne protječe dovoljno krvi, neoplazma se postepeno smanjuje u veličini, atipične stanice prestaju dijeliti i rasti.

Nema informacija o tome kako se događa metabolizam proteina aflibercept. Naučnici sugeriraju da se dijeli na aminokiseline i peptide. Aktivna komponenta izlučuje se iz tijela šest dana sa izmetom. Bubrezi ne sudjeluju u povlačenju sredstava.
Upute za upotrebu "Zaltrap"
Lijek se ubrizgava u venu sat vremena. Doziranje se izračunava na 4 mg po kilogramu tjelesne težine. Kemoterapijski režim će biti sljedeći:
- Prvog dana liječenja primjenjuje se kateter u obliku slova Y, uz pomoć kojeg se intravenske infuzije provode u kombinaciji s irinotekanom, u količini od 180 mg po četvornom metru. Procedura traje 90 minuta. Kalcijum folinat se daje dva sata u dozi od 400 mg i isto toliko fluorouracila,
- Sljedeća infuzija trajat će neprekidno 46 sati. U tom se slučaju fluorouracil daje u dozi od 2400 mg.
Ovaj ciklus liječenja ponavlja se svake dvije sedmice. Ljudima koji imaju dijabetes, doziranje nije potrebno mijenjati.
Infuziju treba da provede lekar koji ima iskustva u hemoterapijskoj praksi.

U nerazređenom obliku i mlazom, lijek se ni u kojem slučaju ne smije davati.
Prije upotrebe, rješenje se pažljivo pregleda. Treba biti odgovarajućeg izgleda bez neolupljenih čestica.
Ne koristite najlonske ili poliviniliden fluoridne filtere tijekom infuzije.
Kako nema podataka o kombinaciji lijeka s drugim lijekovima, dopuštena je samo kombinacija tvari s otopinom natrijevog klorida ili dekstroze.
Samo liječnik treba pripremiti rješenje za intravensku primjenu, poštujući pravila asepsije. Ne koristite bočicu koja sadrži neraztopljene čestice ili se boja lijeka promijenila. Nakon razblaživanja, koncentracija aflibercepta treba biti u području od 0,6–8 mg / ml. Potrebno je odmah upotrijebiti gotov lijek jer se očuvanje fizičke i hemijske stabilnosti može primijetiti samo tijekom dana.
Gdje je bolje kupiti „Zaltrap“, njegovu cijenu i skladištenje
Lijek možete kupiti u ljekarni. Da biste to učinili, morate osigurati recept liječnika. Bez njega, prodaja lijeka je isključena. Cijena boce lijeka iznosi od 8500 rubalja.

Lijek treba biti u prostoriji u kojoj temperatura nije viša od 8, a ne niža od 2 stepena. Lijek se ne smije izlagati izravnoj sunčevoj svjetlosti.
Lijek možete čuvati tri godine od datuma proizvodnje. Nakon isteka ovog razdoblja, ne možete koristiti lijek, pa ga morate zbrinuti.
Recenzije o "Zaltrap"
"Saltrap" je liječio mog oca. Ovo je dobar lijek, djeluje efikasno protiv tumora, ali uvijek se pojave nuspojave. Dobro je što ga ubrizgavaju jednom u dvije sedmice, jer je otac vrlo teško podnio hemoterapiju. No, analize su pokazale da se neoplazma smanjuje.
Nakon uvođenja Zaltrapa, glava me je neprestano bolovala, pojavila se mučnina i povraćanje, stalno sam želio spavati. Ali lijek utječe na tumor vrlo brzo. Stoga, da biste postigli dobar rezultat, možete izdržati.
Iako je lijek prilično skup, a stanje nakon njega grozno, ali zaista pomaže. Uz pomoć nekoliko tečajeva uspjela sam se praktično riješiti tumora. Ljekari kažu da su male šanse za povratak. Prije ovog lijeka liječili su me drugi, ali učinak njih nastavio se kratko vrijeme. Nakon Zaltrapa, već nekoliko godina nisam imao znakove raka.
Bit ćemo vam jako zahvalni ako ga ocijenite i podijelite na društvenim mrežama
Oslobađanje oblika i sastava
Koncentrat iz koga se priprema otopina za infuziju. Bočice imaju volumen od 4 ml i 8 ml. Količina glavne tvari aflibercepta je 25 mg u 1 ml. Druga opcija je gotova sterilna otopina namijenjena za intravensku primjenu. Boja otopine je prozirna ili sa blijedo žutim nijansom.
Glavna komponenta je protein aflibercept. Pomoćne supstance: natrijum-fosfat, limunska kiselina, hlorovodonična kiselina, saharoza, natrijum-hlorid, natrijum-hidroksid, voda.
Aflibercept blokira rad receptora, koji su odgovorni za formiranje novih krvnih žila koje hrane tumor i doprinose njegovom intenzivnom rastu. Ostajući bez opskrbe krvlju, neoplazma počinje smanjivati veličinu. Proces rasta i podjele njegovih atipičnih ćelija se zaustavlja.
Aflibercept blokira aktivnost receptora, koji su odgovorni za stvaranje novih krvnih sudova.
S pažnjom
Potrebno je konstantno praćenje zdravstvenog stanja kod pacijenata sa zatajivanjem bubrega, arterijskom hipertenzijom, koronarnom srčanom bolešću i početnim fazama zatajenja srca. S oprezom se lijek propisuje starijim pacijentima i lošem općem zdravstvenom stanju, ako skala ocjenjivanja nije veća od 2 boda.
Kako uzimati Zaltrap?
Intravenska primjena - infuzija 1 sat. Prosječna doza je 4 mg po kilogramu tjelesne težine. Liječenje se potpisuje na osnovi kemoterapijskog režima:
- prvi dan terapije: intravenska infuzija kateterom u obliku slova Y koji upotrebljava Irinotecan 180 mg / m² tokom 90 minuta, kalcijev folat tokom 120 minuta u dozi od 400 mg / m² i Fluorouracil 400 mg / m²,
- sljedeća kontinuirana infuzija traje 46 sati s dozom Fluorouracila 2400 mg / m².
Intravenska primjena - infuzija 1 sat.
Ciklus se ponavlja svakih 14 dana.
Gastrointestinalni trakt
Proliv, bolovi u trbuhu različitog intenziteta, razvoj hemoroida, stvaranje fistula u anusu, mjehuru, tankom crijevu. Mogući su zubobolja, stomatitis, bolovi u rektumu, vagini. Fistule u probavnom sistemu i perforacija zidova rijetko se javljaju, što može dovesti do smrti pacijenta.
Neželjeni simptomi iz respiratornog sistema: često se javlja dispneja.
Iz kardiovaskularnog sistema
Skokovi krvnog pritiska, unutrašnja krvarenja. Kod mnogih bolesnika: tromboembolija, ishemijski napad, angina pektoris, visoki rizik od infarkta miokarda. Rijetko: otvaranje kraniocerebralnog krvarenja, pljuvanje krvi, obilno krvarenje u gastrointestinalnom traktu, koji su uzrok smrti.
Uticaj na sposobnost upravljanja mehanizmima
Nema podataka o studiji mogućeg učinka lijeka na koncentraciju pažnje. Preporučuje se suzdržati se od vožnje i rada sa složenim mehanizmima ako pacijent ima nuspojave iz centralnog nervnog sistema, psihomotorne poremećaje.
Prije novog ciklusa terapije (svakih 14 dana) potrebno je izvršiti krvni test.
Prije novog ciklusa terapije (svakih 14 dana) potrebno je izvršiti krvni test. Lijek se primjenjuje samo u bolničkom okruženju radi pravodobnog odgovora na znakove dehidracije, perforaciju zidova gastrointestinalnog trakta.
Pacijenti sa općim zdravstvenim indeksom od 2 boda ili većim, imaju rizik od nepovoljnih ishoda. Za pravovremenu dijagnozu pogoršanja zdravlja zahtijevaju stalan medicinski nadzor.
Stvaranje fistula bez obzira na njihovo mjesto, pokazatelj je trenutnog prekida terapije. Zabranjeno je koristiti lijek u liječenju pacijenata koji su bili podvrgnuti opsežnim hirurškim zahvatima (dok se rane u potpunosti ne zacijele).
Muškarci i žene u rodnoj dobi trebaju koristiti različite metode kontracepcije u roku od šest mjeseci (ne manje) nakon posljednje doze Zaltrapa. začeće djeteta treba isključiti.
Rastvor Zaltrap je hiperosmotičan. Njegov sastav isključuje upotrebu lijekova za intraokularni prostor. Zabranjeno je unositi rastvor u staklasto telo.
Upotreba u starosti
Postoji visok rizik od razvoja dugotrajne dijareje, vrtoglavice, brzog gubitka težine i dehidracije kod pacijenata u starosnoj grupi od 65 godina i starijih. Terapija saltrapom treba provoditi samo pod nadzorom medicinskog osoblja. Na prvi znak proljeva ili dehidratacije potrebno je hitno simptomatsko liječenje.
Terapija saltrapom treba provoditi samo pod nadzorom medicinskog osoblja.
Upotreba tokom trudnoće i dojenja
Podaci o primjeni Zaltrapa u trudnica i dojilja nisu dostupni.
S obzirom na moguće rizike negativnih učinaka na dijete, za ove kategorije bolesnika nije propisan antitumorski lijek.
Podaci o tome da li se aktivna komponenta lijeka apsorbira u majčino mlijeko nisu. Ako je potrebno, koristite lijek u liječenju raka dojilje, dojenje mora biti otkazano.
Proizvođač
Sanofi-Aventis Deutschland GmbH, Njemačka.
Terapija lijekovima protiv tumora
Antitumorski efekti vitamina
Ksenia, 55 godina, Moskva: „Tečaj Zaltrap bio je propisan mom ocu za lečenje raka. Lijek je dobar, efikasan, ali izuzetno težak. Uvijek postoje nuspojave. Dobro je da se daje samo jednom u 2 tjedna, jer se nakon hemoterapije stanje oca uvijek privremeno pogoršalo, ali testovi su pokazali pozitivan trend smanjenja neoplazme. "
Eugene, 38 godina, Astana: „Osjetio sam mnoge neželjene efekte Zaltrapa. Stanje je bilo jednostavno strašno: mučnina, povraćanje, stalna glavobolja, jaka slabost. Ali lijek djeluje brzo na tumor. Učinak njegove upotrebe u liječenju raka vrijedi preživjeti sve ove muke. "
Alina, 49 godina, Kemerovo: „Ovo je skup lijek, a stanje nakon hemoterapije s njim je takvo da ne želim živjeti. Ali je efikasan. U 1 kursu mi je tumor gotovo nestao. Ljekar je rekao da postoji mogućnost da dođe do recidiva, ali mali procenat. Ostali lijekovi su korišteni prije Zaltrapa, ali učinak je bio kratkotrajan, a nakon toga već tri godine živim bez znakova raka. "
Zaltrap ubrizgava

Prije uzimanja ovog lijeka, obavijestite svog liječnika o svojim trenutnim lijekovima, dodacima prehrani (npr. Vitaminima, prirodnim dodacima itd.), Alergijskim reakcijama, postojećim bolestima i trenutnim zdravstvenim stanjima (npr. Trudnoći, nadolazećim operacijama itd.).
Nuspojave lijeka mogu biti izraženije u određenom stanju vašeg tijela. Uzmite lijek prema uputama liječnika ili slijedite upute za uporabu koje ste dobili s lijekom. Doziranje lijeka ovisi o vašem stanju. Obavestite svog lekara ako nema promena ili se vaše stanje pogoršava.
Važne su točke o kojima ćete razgovarati sa svojim pružateljem zdravstvene zaštite u nastavku.
- Pažljivo nadgledajte starije pacijente zbog proliva i dehidracije
Saznajte više: Mjere predostrožnosti i pravila upotrebe
Da biste dobili ove informacije, obratite se svom ljekaru, ljekarniku ili pročitajte podatke na pakovanju proizvoda.
Zaltrap Injectable dostupan je u sljedećim paketima sa sljedećim opcijama intenziteta
Dostupno Zaltrap pakovanje za ubrizgavanje: 4MG
Lijek proizvode sljedeće kompanije
- Je li dopušteno rukovanje teškom industrijskom opremom dok uzimate ovaj lijek? Ako osjetite pospanost, vrtoglavicu, hipotenziju ili glavobolju dok uzimate Zaltrap ubrizgavanje, možda ćete se trebati odreći vožnje i teške industrijske opreme.
Trebali biste odustati od vožnje ako vas uzimanje droge čini pospano, vrtoglavica ili hipotenzivna. Ljekari preporučuju da se prekine upotreba alkohola s takvim lijekovima, jer alkohol značajno pojačava nuspojave i pospanost. Molimo provjerite ove efekte na vaše tijelo kada koristite Zaltrap Injectable.
Obavezno se savjetujte sa svojim liječnikom za savjet uzimajući u obzir karakteristike vašeg tijela i općeg zdravstvenog stanja. Da li je ovaj lijek (proizvod) ovisan ili ovisan? Većina lijekova ne izaziva ovisnost ili ovisnost.
U većini slučajeva država klasificira lijekove koji mogu biti ovisni kao lijekovi s kontroliranim oslobađanjem. Na primjer, grafikon H ili X u Indiji i graf II-V u SAD-u. Molimo pročitajte podatke na pakiranju lijeka kako biste bili sigurni da ovaj lijek nije klasificiran kao kontroliran.
Osim toga, ne bavite se liječenjem i ne navikavajte svoje tijelo na lijekove bez savjetovanja s liječnikom. Da li je moguće odmah prestati s uzimanjem ili mi treba postepeno smanjivati dozu? Neki se lijekovi moraju postupno obustaviti zbog efekta oporavka.
Svakako se obratite svom ljekaru za savjet uzimajući u obzir karakteristike vašeg tijela, opće zdravstveno stanje i druge lijekove koje uzimate.
Ako ste propustili sljedeću dozu, uzmite je što prije. Ako se sljedeći sastanak bliži, možete preskočiti prethodni sastanak i nastaviti slijediti svoj uobičajeni raspored lijekova. Ne uzimajte dodatnu dozu da biste nadoknadili propuštenu dozu.
Ako se redovno susrećete sa ovom situacijom, razmislite o postavljanju podsjetnika ili zamolite člana porodice da prati raspored.
Obavezno se obratite svom ljekaru da prilagodi raspored kako bi nadoknadio propušteni lijek (u slučaju da ste propustili značajan broj dana).
- Ne prekoračite preporučenu dozu. Prekomjerna upotreba lijeka neće ublažiti vaše stanje, a može izazvati trovanje i ozbiljne nuspojave. Ako znate za predoziranje Zaltrap ubrizgavanjem, obratite se hitnim službama, najbližoj bolnici ili bolnici.
Obavezno ponesite sa sobom ambalažu, spremnik ili naziv lijeka kako bi se olakšala dijagnoza. Ne prenosite svoje lijekove drugim ljudima, čak i ako su u istom stanju kao i vi, ili vam se čini da vaši uvjeti imaju niz sličnih simptoma, jer to može dovesti do predoziranja.
- Pripravke čuvajte na sobnoj temperaturi, na hladnom mjestu i daleko od direktne sunčeve svjetlosti. Ne zamrzavajte pripravke ako takav zahtjev nije izričito naveden u uputama. Držite lijekove dalje od životinja i djece.
Ne ulijevajte preparate u toalet ili odvodne kanale ako to nije izričito navedeno u uputama. Lijekovi koji se tako odlažu mogu nanijeti značajnu štetu okolišu.
Za više informacija o zbrinjavanju Zaltrap injekcije, obratite se svom ljekaru.
- Čak i pojedinačna doza Zaltrapa koja se ubrizgava može dovesti do ozbiljnih posljedica. Obavezno se posavetujte sa svojim lekarom ako osećate slabost ili bol. Uz to, lijek s istekom roka trajanja može izgubiti svoju efikasnost u borbi protiv vaše bolesti.
Da biste osigurali vlastitu sigurnost, izuzetno je važno odbiti uzimanje lijekova kojima je istekao rok trajanja.
Ako patite od bolesti koja zahtijeva stalne lijekove (srčane bolesti, konvulzije, opasne po život alergijske reakcije), morate uspostaviti pouzdan kanal komunikacije s vašim dobavljačem lijekova kako biste stalno imali zalihe svježih lijekova s normalnim trajanjem.
Molimo kontaktirajte svog zdravstvenog radnika ili ljekarnika, a također pogledajte informacije na ambalaži proizvoda.
- Dailymed LABEL: ZALTRAP-ziv-aflibercept rješenje, koncentrat https://dailymed.nlm.nih.gov/dailymed/dr… - Dobiven pristup: 12. listopada 2016.
- NHS Izbori. Šta trebam učiniti ako propustim dozu antibiotika? - Stekao pristup: 14. jula 2016.
- Jeste li ikada propustili dozu svog lijeka? - Stečen pristup: 3. jula 2016.
- Cancer.Net (2014).
Važnost ispravnog uzimanja lijekova - pristupljeno: 3. jula 2016.
Datumi isteka droga - znače li oni nešto? - Stečen pristup: 1. maja 2016.
Chicago Style Citation
- „Zaltrap ubrizgavajuće tablete - upotrebe, nuspojave, pregledi, sastav, interakcije, mere predostrožnosti, supstituti i doziranje - Sanofi Aventis nas - TabletWise - SAD“ tabletno. Pristupljeno 02. listopada 2018. https://www.tabletwise.com/us-ru/zaltrap-injectable.
Ova stranica sadrži informacije za Zaltrap ubrizgava na ruskom.